用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl= NaCl+H2O +CO2↑
【实验设计】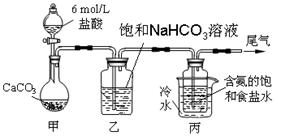
【实验探究】
(1)装置乙的作用是。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。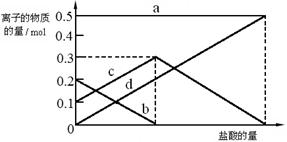
则曲线c对应的溶液中的离子是(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为(填化学式),原NaOH溶液的物质的量浓度为。
(共12分)下图是一套制取并验证氯气部分化学性质的实验装置。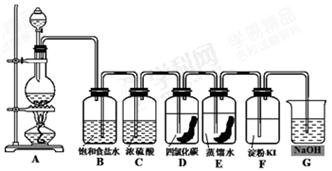
图中,A是Cl2的发生装置,B、C是气体的净化装置,D中盛放浸有有色布条的CCl4溶液,E中盛放浸有有色布条的水溶液,F中盛有淀粉-碘化钾溶液,G烧杯中盛放NaOH溶液。
(1)写出A装置中发生的反应方程式,并用 “ 双线桥法”标出电子的转移方向和数目。
(2)若生成2.8L标准状况时的氯气,被氧化的HCl的物质的量为多少?
(3)上述装置中有一处错误,请指出是处(用装置字母表示)。
(4)B中饱和食盐水的作用是;C中浓硫酸的作用是
(5)有色布条褪色的是 (选择 “D”或“E”或“D、E”),由此可知具有漂白作用的物质是(填化学式)。F中出现的现象是
(6)G烧杯中NaOH溶液的作用是,发生的化学反应方程式:
(共13分)实验室需要90mL 2.0 mol·L-1的Na2CO3溶液,现用无水碳酸钠粉未配制;请回答下列问题:
(1)请先通过计算(要有计算过程),再确定称取g无水碳酸钠。
(2)下列仪器中,不会用到的是
A.50mL容量瓶; B.100mL容量瓶; C.玻棒;
D.100mL量筒; E.托盘天平;F.药匙
(3)若要实施配制,除上述仪器外,尚缺的仪器是。
(4)容量瓶在使用前必须进行的操作是。
(5)配制过程简述为以下各步:其正确的操作顺序为(填各步骤序号)。
A.冷却至室温; B.洗涤并移液; C.称取; D.溶解;
E.摇匀装瓶; F.定容; G.移液
(6)在配制过程中,下列情况对浓度有何影响?
①容量瓶用蒸馏水洗净后,没等到干燥,就移入溶液定容,则所配溶液的浓度(填“偏高”或“偏低”或“无影响”,下同);
② 转移溶液时,不小心有溶液溅在瓶外,则所配溶液的浓度
③定容时若俯视刻度线,则所配溶液的浓度
④若在滴加蒸馏水时,不慎超过了刻度线,则所配溶液的浓度。此时应如何处理?。
(18分)某化学小组采用下图装置,以环己醇制备环己烯: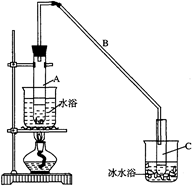
已知: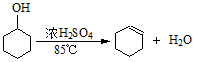
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
已知:温度高于100℃时,原料环己醇易和水形成共沸物一起被蒸出反应体系。
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是。
②加热试管A采用热水浴,而非直接加热。目的是,试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填“上”或“下”),分液后用(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从口进入(填字母)。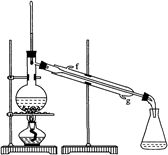
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是(填序号)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是(填序号)
①和Na2SO3溶液②酸性KMnO4溶液③石灰水
④无水CuSO4⑤品红溶液
溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下: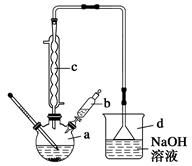
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
进一步提纯粗产品,还必须进行的实验操作名称是。
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 在水中的溶解度 |
微溶 |
微溶 |
微溶 |