某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、
NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: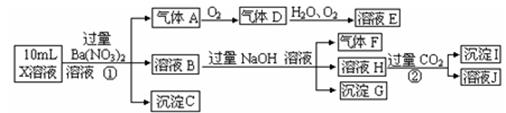
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子(Q)是_________,若要确定该Q(若不止一种,可任选一种)不存在,检验的最可靠的化学方法是_______________________。
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A_______________________。②_____________________________。
(4)假设测定A、F、I均为0.01mol, 10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
(8分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
 ①2Mg+O2
①2Mg+O2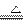 2MgO;
2MgO;
②3Mg+N2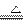 Mg3N2;
Mg3N2;
③2Mg+CO2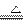 2MgO+C;
2MgO+C; ④Mg+H2O
④Mg+H2O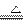 MgO+H2↑;
MgO+H2↑;
⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
 可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。 回答下列问题
回答下列问题



 (1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)。
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)。 (2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)。 (3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
,原因是。 (4)请设计一个实验,验证产物是氮化镁:。
(4)请设计一个实验,验证产物是氮化镁:。
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题: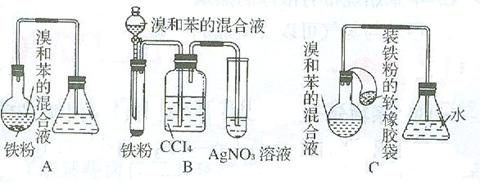
(1)写出三个装置中共同发生反应的化学方程式:___________________
(2)装置A和C均采用了长玻璃导管,其作用是_____________________________
(3)按装置B、C装好仪器及药品后,要使反应开始,应对装置B进行的操作是_________,应对装置C进行的操作是 ___________________________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作,装置A中这一问题在实验中造成的后果是________________________。
(5)B中采用了洗气瓶吸收装置,反应后洗气瓶中可能出现的现象是_______
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1)装置中X仪器的名称是:;
碎瓷片的作用是:。
(2)写出生成乙烯的化学反应方程式:。
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品 红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A.;B.;C.;D.。
(4)能说明SO2气体存在的现象是。
(5)确证含有乙烯的现象是。
(8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂: a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO
分离方法:①.分液②.过滤③.洗气④.蒸馏
| 混合物 |
需加入的试剂 |
分离方法 |
| 溴苯(溴) |
||
| 乙烷(乙烯) |
||
| 乙醇(水) |
||
| 乙酸乙酯(乙酸) |