有A、B、C、D、E、F六种有机物,在一定条件下可发生如右图所示的转化关系。A可作为衡量一个国家石油化工发展水平的标志之一,A可氧化生成D,D与新制的Cu(OH)2悬浊液共热可生成一种砖红色沉淀,A与NaOH溶液共热得到C和无机盐NaX,在经硝酸酸化的NaX溶液中加入硝酸银溶液会产生淡黄色沉淀,燃烧等物质的量的这六种有机物,F燃烧产生的CO2的物质的量是其他有机物的2倍,只有C与E能与钠反应产生气泡。试推断:
⑴各物质的结构简式:A ;B ;C ;D ;E ;F 。
⑵C在浓硫酸作用下加热到170℃可制取A,写出该反应的化学方程式:
___________________________________ 。
⑶下列反应中属于氧化反应的是(填写序号) 。
①D→E ②D→C ③E→F ④C→D ⑤F→E
下列反应中,属于放热反应的是_____________,属于吸热反应的是___________。
| A.盐酸与烧碱溶液反应 | |
| B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑ | |
| C.氢气在氧气中燃烧生成水 | D.高温煅烧石灰石使其分解 |
E.铝和盐酸反应 F.葡萄糖在人体内氧化分解
(1)卤素元素包括______、______、______ 、______(填元素符号),随核电荷数递增,它们的原子半径依次_______,单质的氧化性依次_______。
(2)在1-18号元素中(稀有气体元素除外),元素所形成的最稳定的气态氢化物是________;与水或酸反应最剧烈的单质是________;最高价氧化物的水化物中碱性最强的碱是__________;最高价氧化物的水化物中酸性最强的酸是__________。(填化学式)
五种短周期元素A、B、C、D、E,原子序数依次增大,其中A、B同周期,且A、B原子核外均有两个未成对电子;A、D同主族,B、E同主族,且C的最外层电子比E的最外层电子少5个。根据以上信息,完成下列各题。
(1)写出下列化学用语:A:B:C:D:E:
(2)A的最高价氧化物的熔点D的最高价氧化物的熔点(填“>”或“<”),原因是;B氢化物的沸点E氢化物的沸点(填“>”或“<”),原因是。
(3)选取上述五种元素,完成下列问题
①构成的原子晶体有;
②含有非极性键的离子化合物(用电子式表示)
③含有极性键的非极性分子(用电子式表示)
现有X、Y、Z、W四种短周期元素。
①X元素的单质在Y元素的单质中燃烧发出苍白色火焰,并生成气体A。
②Z元素的单质与A的水溶液反应又生成X元素的单质。
③Z元素的原子和Y元素的原子电子层数相同,且它们的最外层电子数之差的绝对值为奇数。
④W元素的原子核外有3个电子层,其最外层电子数等于电子层数。
请回答下列问题:
(1)X的元素符号为:_________;Z的元素名称是:。
(2)A的电子式是。
(3)Z的单质与A的溶液反应的离子方程式。
(4)W的氧化物溶于NaOH中的化学方程式。
第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。
(1)已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;
(2)硼酸的结构式可表示为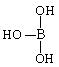 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:(共4分)
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:(共4分)