实验室制乙烯时, 常因温度过高而发生副反应。部分乙醇跟浓硫酸反应生成二氧化硫.二氧化碳.水蒸气和炭黑。请用下列编号为①~⑥的实验装置设计一个实验, 以验证上述反应后的混合气中含有二氧化碳.二氧化硫和水蒸气。
(1)用装置的编号表示其连接顺序(按气体产物从左到右的流向)
(2)装置⑤中的固体药品为 现象是
(3)装置①中的现象是 ,验证 ; 装置②中溴水的作用是 ,此时盛有澄清石灰水的装置④中出现 ,
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金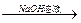 测定剩余固体质量。
测定剩余固体质量。
问题:实验中发生反应的化学方程式是
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2、0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”或“偏低”)。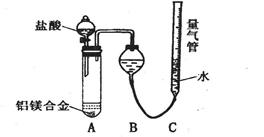
【探究二】实验方案:铝镁合金 测定生成气体的体积实验装置。
测定生成气体的体积实验装置。
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①
②
根据实验室中测定硫酸铜晶体(CuS04·XH20)结晶水含量的实验,填写下列空白:
(1) 从下列仪器选出无需用到的仪器是(用标号字母填写)。
(A) 电子天平 (B) 坩埚钳 (C) 试管夹 (D) 酒精灯 (E) 蒸发皿
(F) 玻璃棒 (G) 坩埚 (H) 干燥器 (I) 石棉网 (J) 三脚架(K)泥三角
除上述仪器外,还需要的仪器是。
(2) 某学生实验后得到以下数据:
| 加热前质量 |
加热后质量 |
|
| W1(容器) |
W2(容器+晶体) |
W3(容器+无水硫酸铜) |
| 5.4g |
7.9g |
6.8g |
请写出结晶水含量(H2O%)和X的值的计算公式(用W1、W2、W3表示)
H2O %= ,X=, 该生测定结果是偏高还是偏低? 。
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)。
(A) 加热过程中晶体有少量溅失;
(B) 加热前称量时容器未完全干燥;
(C) 最后两次加热后的质量相差较大(大于0.1克);
(D) 加热后容器未放入干燥器中冷却;
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行________操作。
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置.
(1)要将C装置接入B和D之间,正确的接法是:a→________→________→ d.
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____________________________.为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_______________________.
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________________________,B的作用是________________________________.
(4)用量筒量取20 mL E中溶液,倒入已检查完气密性良好的分液漏 斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液
斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液 和下层液,呈黄绿色的是________(填“上层液”或“下层液”),能使有色布条褪色的是________(填“上层液”或“下层液”).
和下层液,呈黄绿色的是________(填“上层液”或“下层液”),能使有色布条褪色的是________(填“上层液”或“下层液”).
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
①洗气瓶中浓硫酸的作用是。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);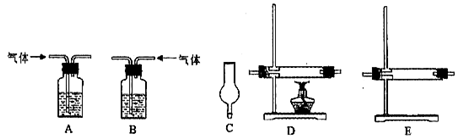
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为mol。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。


(1)制备粗品将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出