根据实验室中测定硫酸铜晶体(CuS04·XH20)结晶水含量的实验,填写下列空白:
(1) 从下列仪器选出无需用到的仪器是(用标号字母填写) 。
(A) 电子天平 (B) 坩埚钳 (C) 试管夹 (D) 酒精灯 (E) 蒸发皿
(F) 玻璃棒 (G) 坩埚 (H) 干燥器 (I) 石棉网 (J) 三脚架 (K)泥三角
除上述仪器外,还需要的仪器是 。
(2) 某学生实验后得到以下数据:
| 加热前质量 |
加热后质量 |
|
| W1(容器) |
W2(容器+晶体) |
W3(容器+无水硫酸铜) |
| 5.4g |
7.9g |
6.8g |
请写出结晶水含量(H2O%)和X的值的计算公式(用W1、W2、W3表示)
H2O %= ,X= , 该生测定结果是偏高还是偏低? 。
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母) 。
(A) 加热过程中晶体有少量溅失;
(B) 加热前称量时容器未完全干燥;
(C) 最后两次加热后的质量相差较大(大于0.1克);
(D) 加热后容器未放入干燥器中冷却;
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行________操作。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制备氧气 |
H2O2→O2 |
|
| ② |
制备氨气 |
NH4Cl→NH3 |
|
| ③ |
制备氯气 |
HCl→Cl2 |
(1)从上述气体制备原理中:从制备过程看,必须选择合适的氧化剂才能实现的是(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质: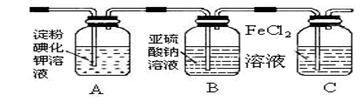
①通入氯气后,A中的现象是,
整套实验装置存在的明显缺陷是。
②C装置中发生反应的离子方程式为:。
(1)用5.0mol﹒L-1的NaOH溶液配制0.1mol﹒L-1的NaOH溶液时,如图所示的仪器中,肯定不需要的是(填序号),配制上述溶液还需要的玻璃仪器
是(填仪器名称)。
(2)在配制过程中,下列操作将导致所配溶液浓度偏低的是(填编号)
①准确取出的浓NaOH溶液在空气中露置时间过长;
②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;
④稀释NaOH溶液的仪器未洗涤。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
(1)“调节pH=4”可选用的试剂是(填编号)。
①MgO ②CuO ③MgCO3④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是。
(3)“滤渣”的主要成分为。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;②;③;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式:。
②产品中Mg(ClO3)2•6H2O的质量分数为。
(14分)乙酸异戊酯(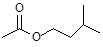 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下: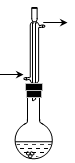
实验步骤:在烧瓶中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热烧瓶,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁晶体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
| 相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解性 |
|
| 异戊醇 |
88 |
0.8123 |
131 |
微溶 |
| 乙酸 |
60 |
1.0492 |
118 |
溶 |
| 乙酸异戊酯 |
130 |
0.8670 |
142 |
难溶 |
(1)写出制取乙酸异戊酯的化学方程式。
(2)冷凝管的作用是,碎瓷片的作用是。
(3)若乙酸异戊酯产率偏低,其原因可能是。
A.原料没有充分反应
B.发生了副反应
C.在进行蒸馏纯化操作时,从143 ℃开始收集馏分
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)实验中加入少量无水硫酸镁的目的是。
(6)本实验的产率是
A.30℅B.40℅C.50℅ D.60℅
草酸与高锰酸钾在酸性条件下能够发生反应,现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)该反应的离子方程式为。
(2)该反应中氧化剂和还原剂的物质的量之比为。
(3)如果研究催化剂对化学反应速率的影响,使用实验I和Ⅱ;如果研究温度对化学反应速率的影响,使用实验(用I~IV表示)。
对比实验I和IV,可以研究对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是。