 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。 (1)B、C两元素的名称为: ;
(1)B、C两元素的名称为: ; (2)用电子式表示C2D的形成过程: 。
(2)用电子式表示C2D的形成过程: 。 (3)由B、C两元素所形成的原子个数比为1:1的化合物属于 (填“离子” 或“共价”)化合物,存在的化学键的种类有 ,
(3)由B、C两元素所形成的原子个数比为1:1的化合物属于 (填“离子” 或“共价”)化合物,存在的化学键的种类有 ,
写出它与水反应的离子方程式____ 。 (4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为 。此实验中常加入一种黑色粉未物质,其作用是 。
(4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为 。此实验中常加入一种黑色粉未物质,其作用是 。
将一定质量的Mg,Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。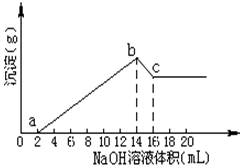
(1)原合金中Mg的质量为g;Al的质量为g
(2)盐酸的物质的量浓度为mol/L
有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为: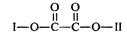 (其中I、II为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
(其中I、II为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程: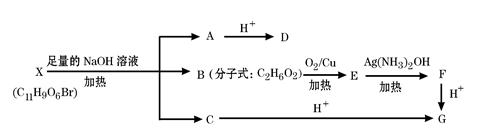
已知向D的水溶液中滴入FeCl3溶液显紫色,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物只有两种。
(1)D中除羟基外另 一种含氧官能团的名称是:;X的结构简式为:;
一种含氧官能团的名称是:;X的结构简式为:;
(2)写出B→E的化学方程式:;
(3)D不可能发生的反应有:(填字母标号)
| A.加成反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(4)D有多种同分异构体,请写出一种同时满足下列三个条件的同分异构体的结构简式:。
①遇FeCl3溶液发生显色反应②能发生银镜反应,③能发生水解反应
美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下: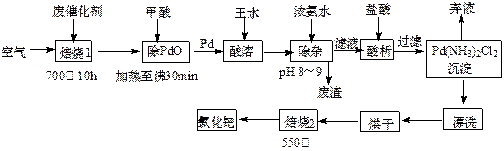
(1)甲酸在反应中的作用是(选填:“氧化剂”或“还原剂”);
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是(写化学式);
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为,
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为;
(4)700℃“焙烧1”的目的是,550℃“焙烧2”的目的是。
I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g)ΔH=a kJ·mol-1
4NH3 (g)+3O2 (g)ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K |
303 |
313 |
323 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a0 (填“> ”“<”或“=”)
”“<”或“=”)
②已知:
N2 (g) + 3H2(g) 2NH3 (g)ΔH=-92.4kJ·mol-1,
2NH3 (g)ΔH=-92.4kJ·mol-1,
2H2 (g) + O2 (g)===2H2O (l)ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l) 4NH3 (g) + 3O2 (g)ΔH=;
4NH3 (g) + 3O2 (g)ΔH=;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是(填字母标号)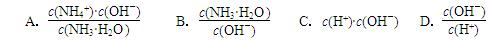
II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g) 2SO3 (g)ΔH=-196.0kJ·mol-1
2SO3 (g)ΔH=-196.0kJ·mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是(填字母标号)
| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
②某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是,该温度下的平衡常数K=;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将。
(10 分)
乙基香兰素的键线式结构如图,它是当今世界上最重要的合成香料之一。
(1)以下推测正确的是______ (填字母)。
a.从成键方式看,所含碳氧双键中有一个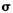 键和一个
键和一个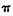 键
键
b.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
c.1 mol该物质最多能与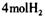
 发生加成反应
发生加成反应
d.该物质能使酸性高锰酸钾溶液褪色,也能与碳酸钠溶液反应产生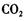 气体
气体
(2)已知R物质是乙基香兰素的同分异构体,其性质如下: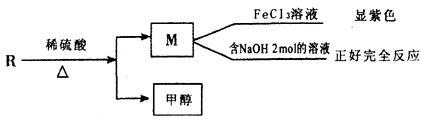
R符合上述条件,且lmol R与溴水发生取代反应时,消耗1mol溴,试写出符合要求的Fl的结构简式__________、___________、_________________;
(3)X也是乙基香兰素的同兮异构体,其结构简式为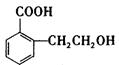
可以通过不同的反应制得下列物质。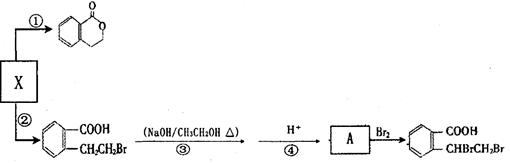
请回答下列问题:
A 反应③的反应类________________ 型_______;
B 反应①的化学方程式____________