(10分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
| 化学键 |
Cl-Cl |
H—H |
H—Cl |
N≡N |
| 键能/kJ·mol |
243 |
436 |
431 |
946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g)= 2NH3(g) ΔH="-92" kJ/mol,则N—H键的键能是 kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 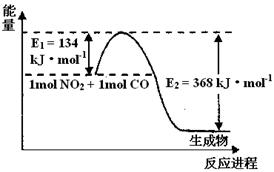
(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=" CO(g)" + 2H2O(l)ΔH = (用含ΔH1、ΔH2、ΔH3的式子表示)
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=" -1" 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=" -815.88" kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________。
按要求回答下列问题:
(1)画出第三周期核外未成对电子最多的基态原子的价电子排布图______________;
(2)写出族序数为周期数三倍的主族元素的原子电子排布式_____________________;
(3)用价层电子对互斥模型推测下列分子或离子的空间构型及中心原子的杂化方式。
SCl2 _________、__________;BeCl2_________、_________;
(4)写出所给微粒的一种等电子体的化学式:SO2 : SO42-___________.
“碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃下进行实验,得到 的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是_____________________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________
________________________________________________________________________。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
在一密闭容器内盛由HBr气体。在一定温度下进行反应:
2HI(g) H2(g)+ I2(g)(正反应为放热反应)达平衡。若升高温度,则
H2(g)+ I2(g)(正反应为放热反应)达平衡。若升高温度,则
①正反应速率___________,逆反应速率___________(填“加快”“减慢”或“不变”)
②化学平衡向__________________移动(填“正反应方向”“逆反应方向”或“不”)
③混合气体的颜色应变______________(填“深”、“浅”或“不变”)
④混合气体平均相对分子质量_______化学平衡常数将_____(填“增大”、“减小”或“不变”)
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol·Lˉ1。反应进行2min后A的浓度为0.8 mol·Lˉ1,B的浓度为0.6 mol·Lˉ1,C的浓度为0.6 mol·Lˉ1。则2min内反应的平均速率VA=__________,VB=_____________,VC=___________。该反应的化学反应方程式为___________________________。