在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g)DH =" +" a kJ·mol-1
N2 (g) + 3H2(g)DH =" +" a kJ·mol-1
请回答下列问题:
(1)已知:2H2 (g) + O2 (g) =2H2O(l)DH =" -" b kJ·mol-1
NH3 (g)  NH3(l)DH =" -" c kJ·mol-1
NH3(l)DH =" -" c kJ·mol-1
则4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的DH = kJ·mol-1。
(2)水能发生电离:2H2O(l)  H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是 ,标准状况下阴极得到的气体的质量为 g。
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
| A.容器内气体密度保持不变 | B.CO与CO2的物质的量之比保持不变 |
| C.H2O与CO2的生成速率之比为1∶1 | D.该反应的平衡常数保持不变 |
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。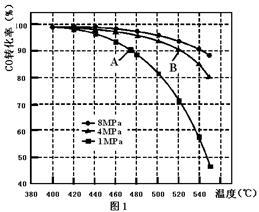
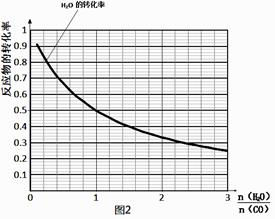
(4)一定温度下,密闭容器中发生反应③,水蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
(1)25℃时,①0.1mol·L-1的醋酸 ②0.1mol·L-1的硫酸 ③0.1mol·L-1的氨水的④0.1mol·L-1的NaOH溶液,其pH由小到大的顺序是 (填序号)
(2)下列物质中①NaCl ②BaSO4 ③稀硫酸 ④KOH ⑤H2O ⑥CH3COOH ⑦NH3 ⑧蔗糖 ⑨SO2 ⑩Cu,其中属于强电解质的有 ;其中属于弱电解质的有 ;其中属于非电解质的有 。
(3)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A) pH(B) (填“>”、“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) V(B)(填“>”、“=”或“<”)。
(4)已知:二元酸H2R 的电离方程式是:H2R=H++HR-,HR- R2- + H+,若0.1 mol·L-1NaHR溶液的c(H+)="a" mol·L-1
R2- + H+,若0.1 mol·L-1NaHR溶液的c(H+)="a" mol·L-1 ,则0.1mol·L-1H2R溶液中c(H+) (0.1+a) mol·L-1(填“<”、“>”或“=”),理由是 。
,则0.1mol·L-1H2R溶液中c(H+) (0.1+a) mol·L-1(填“<”、“>”或“=”),理由是 。
(5) 25℃时,若10体积某强碱溶液与1体积的某强酸溶液混合后,溶液的pH=7,则混合前,该强碱溶液的pH(强碱)与强酸溶液pH(强酸)之间应满足的关系是 。
下列微粒中:①Na+;② Fe3+ ;③ Cl-;④HCO3-;⑤ AlO2-
(1)既能电离又能水解的微粒是 (填序号)。
(2)②、③两种离子组成的盐的水溶液显 (填“酸性”或“碱性”或“中性”),用离子方程式表示原因 。
(3)④、⑤两种离子在水溶液中会发生反应而生成沉淀,写出相应的离子方程式 。
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0;
(2)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.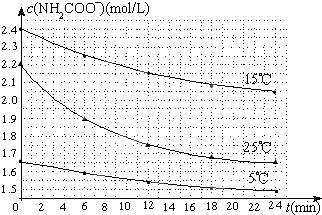
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。