Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。
⑴Q的最高价氧化物,其固体属于 晶体,比较Q、X、Y 第一电离能由大到小的顺序 。
⑵ R的氢化物属于 分子(填“极性”或“非极性”)。
⑶X的常见氢化物的VSEPR模型是 ;
⑷已知Ti3+可 形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测
形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测 溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为 。
溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为 。
(1)用单线桥表示下列反应中电子转移方向和数目:
KIO3+6HI =KCl+3H2O+3I2
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素,测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是__________;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂__________ mol,有__________mol电子发生转移,相当于测出含钙元素的质量是_____g。
【加试题】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若绍兴全市的100余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨。甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2⇌CH3OH 。
请根据图示回答下列: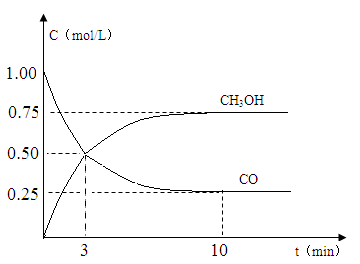
(1)关于该自发反应的下列说法中,正确的是 (填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,CO的平均反应速率v(CO)= mol/(L•min),该反应的平衡常数K= 。
(3)恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO)增大的有 。
A.升高温度 B.充入He气 C.再冲入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量= g/mol。
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g) Ni(CO)4(g),△H<0;
Ni(CO)4(g),△H<0;
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是_______(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,△H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+ 1/2O2(g)=CO2(g)△H=-Q1 kJ•mol-1
S(s) +O2(g) =SO2(g)△H=-Q2 kJ•mol-1
则SO2(g) +2CO(g) ="S(s)" +2CO2(g)△H=________________;
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系_______________;
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为_______(最简分数形式);
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________;若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。
短周期元素A、B、C、D、E,A为原子半径最小的元素,A、D同主族,D、E同周期,CE同主族且E的原子序数为C的原子序数的2倍,B为组成物质种类最多的元素。
(1)E离子的原子结构示意图__________________;
(2)分别由A、C、D、E四种元素组成的两种盐可相互反应得到气体,写出这个反应的离子方程式__________________;
(3)由A、B、C三种元素组成的物质X,式量为46,在一定条件下与C、D两种元素的单质均可反应.写出X与C单质在红热的铜丝存在时反应的化学方程式__________________;
(4)A、C、D三种元素组成的化合物Y中含有的化学键为_______________,B的最高价氧化物与等物质的量的Y溶液反应后,溶液显________(“酸”、“碱”或“中”)性,原因是________________;
(5)A的气体单质和C的气体单质可发生反应,在“神舟六号”飞船上使用了根据这反应设计的燃料电池,电解质溶液为KOH溶液,电池负极反应为__________,使用这种电池的优点为_____________;
铅及其化合物在工业生产生活中都具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)↑H="a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)↑H="b" kJ•mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)↑H="c" kJ•mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=_____________kJ•mol-1(用含a,b,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g) Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H____0(选填:“>”“<”“=”)。
②当lgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为_______。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为_______。
(4)PbI2:可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图).加入酚酞指示剂,用0.0025mol•L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时PbI2 Ksp为_______。
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图1所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图2所示.
①常温下,pH=6→7时,铅形态间转化的离子方程式为____________________。
②用活性炭处理,铅的去除率较高时,铅主要应该处于________(填铅的一种形态的化学式)形态.