铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝离子的结构示意图为 。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为 。
(3)氢氧化铝是医用的胃酸中和剂的一种。用离子方程式表示其作用机理是 。
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是 (填字母序号)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对。 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
Ⅰ对;Ⅱ对。 |
| C |
铁比铝更易锈蚀 |
铝比铁活泼 |
Ⅰ错;Ⅱ对。 |
| D |
铝在空气中表面生成致密氧化膜 |
可用铝罐储存运输浓硫酸、浓硝酸 |
Ⅰ错;Ⅱ对。 |
(6)钢铁的析氢腐蚀简单示意图如下图所示,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图。
现有以下物质:①NaCl固体②盐酸③Ba(OH)2溶液 ④铜⑤二氧化碳气体⑥硫酸氢钾固体⑦乙醇(C2H5OH)⑧液态硫酸⑨熔融态BaSO4⑩液态SO3
请回答下列问题(用序号):
以上物质中属于化合物的是____________(填序号,下同),属于盐的是_____________,属于氧化物的是__________,能导电的是___________________,属于电解质的是__________________,属于非电解质的是___________________。
室温下将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=12,则强碱溶液和强酸溶液的体积之比为 。
下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
KHCO3 ,溶液呈 性;
K2SO4 ,溶液呈 性;
CuCl2 ,溶液呈 性。
HF的电离过程中,升高温度,电离平衡 (填“正向”“逆向”“不”下同)移动,加入NaF固体,平衡 移动。
室温下,在纯水中加入0.1mol/L HCl ,水的电离平衡 移动,若加入0.1mol/L NH4Cl ,水的电离平衡 移动
如图是在一定温度下,向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是______,与B图变化趋势一致的是______,与C图变化趋势一致的是______。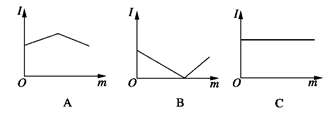
①氢氧化钡溶液中滴入硫酸溶液至过量;
②醋酸溶液中滴入氨水至过量;
③澄清石灰水中通入CO2至过量
④氯化铵溶液中逐渐加入适量氢氧化钠固体