下列离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| B.铜与稀硝酸反应:Cu+4H+ +NO3— |
| C.向100mL1mol/L的FeBr2溶液中通入 0.15mol Cl2: 2Fe2++4Br-+3Cl2= 2Fe3++2Br2+6Cl- |
| D.硫酸与氢氧化钡在溶液中反应: Ba2++OH—+H++SO42— |
绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是()
A.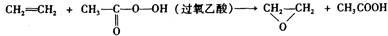 |
B.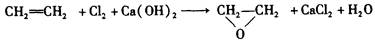 |
C.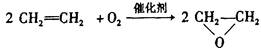 |
D.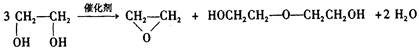 |
下列变化规律不正确的是()
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
在容积为2L的密闭容器中,有反应:mA (g) + nB (g) pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min),C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为()
pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min),C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为()
| A.3:1:2:2 | B.1:3:2:2 | C.1:3:2:1 | D.1:1:1:1 |
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体。下列叙述正确的是()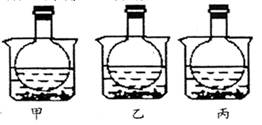
| A.甲烧瓶中气体颜色变浅 |
| B.乙烧瓶中气体颜色变深 |
| C.丙烧瓶中气体压强明显增大 |
| D.上述三种说法都不正确 |
煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应方程式为:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,为了提高SO2的生成速率,下列措施可行的()
| A.增加硫铁矿石的投入量 | B.增加炉的高度 |
| C.降低温度 | D.升高温度 |