某无色溶液含有①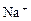 、②
、②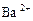 、③
、③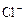 、④
、④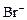 、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加足量氯水,再加入CCl4振荡,静置 |
CCl4 层呈橙色 |
| (3) |
向所得水溶液中加入足量Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
| A.肯定含有的离子是③④⑥ | B.肯定含有的离子是①④⑤ |
C.不能确定的 离子是①③⑤ 离子是①③⑤ |
D.肯定没有的离子是②③⑤ |
下列各组微粒,半径大小比较中错误的是 ( )
| A.K >Na >Li | B.Na+>Mg2+>Al3+ |
| C.Mg2+>Na+>F— | D.Cl—>F—>F |
下列说法中正确的是()
| A.随原子序数的递增,第三周期元素的电负性逐渐减小 |
| B.铝的第一电离能比镁的第一电离能大 |
| C.在所有的元素中,氟的第一电离能最大 |
| D.在所有的元素中,氟的电负性最大 |
某元素原子3d轨道上有5个电子,则该原子最外层电子的排布可能是()
| A.4s1 | B.4s24p1 | C.4s24p3 | D.3s23p63d5 |
下列基态原子或离子的电子排布式错误的是( )
| A.K 1s22s22p63s23p64s1 | B.Mg2+ 1s22s22p6 |
| C.F- 1s22s22p5 | D.Br 1s22s22p63s23p63d104s24p5 |
按能量由低到高的顺序排列,正确的一组是()
| A.1s、2p、3d、4s | B.1s、2s、3s、2p |
| C.2s、2p、3s、3p | D.4p、3d、4s、3p |