(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 ,负极的电极反应式是 。
(3)如图是一个电化学过程示意图。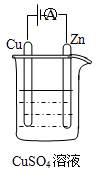
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化
128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L。
(假设空气中氧气体积含量为20%)
[选修5—有机化学基础]18—Ⅰ下列有机物的命名错误的是
18—Ⅱ芳香族化合物A可进行如下转化:
回答下列问题:
(1)B的化学名称为 。
(2)由C合成涤纶的化学方程式为 。
(3)E的苯环上一氯代物仅有两种,E的结构简式为 。
(4)写出A所有可能的结构简式 。
(5)写出符合下列条件的E的同分异构体的结构简式 。
①核磁共振氢谱显示苯环上仅有两种氢
②可发生银镜反应和水解反应
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol-1。
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)下图所示原电池正极的反应式为 。
单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z、X中共价键的类型分别是 。
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
回答下列问题:
(1)A的结构简式为 。
(2)B的化学名称是 。
(3)由乙醇生产C的化学反应类型为 。
(4)E是一种常见的塑料,其化学名称是 。
(5)由乙醇生成F的化学方程式为 。