从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
(1) 甲中除苯环外,官能团的名称为 。
(2) 由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
则Ⅰ的反应类型为 ,Ⅱ的化学方程式为 (注明反应条件)。
(3)已知:
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):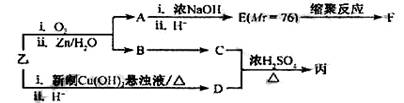
①下列物质不能与C反应的是 (选填序号)
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式 。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式
。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为 。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是
。
(2)25℃ 下,将pH=13的氢氧化钠溶液与pH=1的稀盐酸等体积混合,所得混合溶液的pH=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性(填“酸”、 “中”或“碱”),溶液中c(Na+)c(CH3COO-)[填“>”、“=”或“<”] 。
(1)在25℃、101kPa下,16g甲烷燃烧生成CO2和液态水时放热889.6kJ。则表示甲烷燃烧的热化学方程式为_________________________________________________。
(2) 下列说法正确的是(填序号)____:(漏选得1分,错选、多选得0分)
| A.相同温度下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大; |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
D.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电 Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电 |
离平衡;
E. 除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比
MgCO3的大;
下表是不同温度下水的离子积数据:
| 温度 / ℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是________________________________________________________。
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关
系正确的是______________
A.c(Na+)>c(HCO )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO )
)
B.c(Na+)+c(H+)=c(HCO )+c(CO
)+c(CO )+c(OH-)
)+c(OH-)
C.c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(OH-)=c(HCO )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。
已知可逆反应CO + H2O (g) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K=。
(2)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(4)若830K时,起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a= ________c。
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):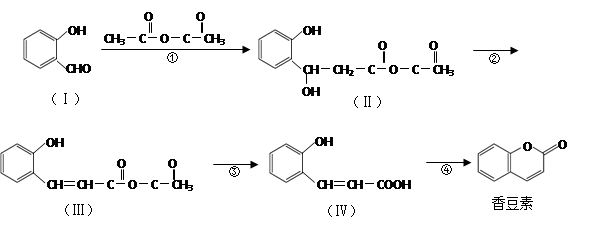
(1)Ⅰ的分子式为_____________;
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为_______________________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下, 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。