从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素。
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐 ▲ kg,你觉得服用碘盐防辐射合理吗? ▲ 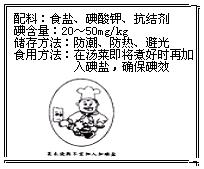 II.右图为某加碘盐标签的一部分。
II.右图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以
下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移
至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 |
碱式滴定管读数 |
消耗体积(mL) |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
0 |
如图一 |
|
| 2 |
0 |
23.98 |
23.98 |
| 3 |
0 |
24.02 |
24.02 |
(1)第一次读数为 ▲ mL。
(2)滴定终点的判断方法 ▲ 。
(3)经过计算,此加碘盐碘元素的含量为 ▲ mg/kg(用包含a、b的最简表达式表示)。
(4)下列操作可能会导致测量结果偏低的是 ▲ 。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)  2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
| A.平衡常数K值越大,X的转化率越大 |
| B.达到平衡时,反应速率v正(X)=2v逆(Z) |
| C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
对于反应A(s)+2B(g)  3C(g) ΔH>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是( )
3C(g) ΔH>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是( )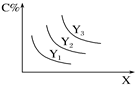
| A.X表示温度,Y表示压强,且Y1>Y2>Y3 |
| B.Y表示压强,X表示温度,且Y3>Y2>Y1 |
| C.X表示压强,Y表示温度,且Y1>Y2>Y3 |
| D.Y表示温度,X表示压强,且Y3>Y2>Y1 |
对于可逆反应:mA(g)+nB(g)  xC(g) ΔH=?,在不同温度及压强(p1、p2)条件下,反应物A的转化率如图所示,下列判断正确的是( )
xC(g) ΔH=?,在不同温度及压强(p1、p2)条件下,反应物A的转化率如图所示,下列判断正确的是( )
| A.ΔH>0,m+n>x | B.ΔH>0,m+n<x |
| C.ΔH<0,m+n<x | D.ΔH<0,m+n>x |
在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 |
H2[来源:] |
CO |
H2O |
|
| 甲 |
amol |
amol |
0mol |
0mol[来 |
| 乙 |
2amol |
amol |
0mol |
0mol |
| 丙 |
0mol |
0mol |
amol |
amol |
| 丁 |
amol |
0mol |
amol |
amol |
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲 B.丁>丙>乙>甲 C.丁>乙>丙=甲 D.乙=丁<甲=丙
一定温度下,可逆反应A2(s)+3B2(g)  2AB3(g)达到平衡的标志是()
2AB3(g)达到平衡的标志是()
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时消耗3mol B2 |
| C.混合气体总的物质的量不变 |
| D.密闭容器内的物质的质量不再改变 |