动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
||||
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
|
||||
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
||||
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,烧杯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号)(各1分)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
|
|
|
|
|
|
步骤①的化学方程式: ,
步骤⑥的离子方程式 ,
此实验的结论: 。
( 9分)重铬酸钾(K2Cr2O7)是重要氧化剂,重铬酸钾的溶解度受温度影响较大,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2•Al2O3)为原料生产它。实验室模拟工业上用铬铁矿制 K2CrO7的主要工艺流程如下图。涉及“碱熔”的主要反应为:
6 FeO•Cr2O3 + 24NaOH + 7KC1O3 = 12NaCrO4 + 3Fe2O3 + 7KCl + 12H2O
(1)使用粉末状铬铁矿的目的是。
(2)调节pH后,过滤得到的滤渣是(填化学式)。
(3)酸化Na2CrO4溶液时,其平衡转化的离子方程式为。
(4)称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加入10 mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100 mL 水,加人3mL淀粉溶液(作指示剂),用0.1200 mol/LNa2S2O3标准溶液滴定( I2 + 2S2O2- 3= 2I-+S4O2- 6),用去20.00mL ,则该样品的纯度为。
新型材料纳米级铁粉与普通铁粉具有不同的性质。已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4。
(1)写出温度高于570℃时反应的化学方程式
。
(2)中学教材中用下图所示实验装置,完成铁粉与水蒸气反应的演示实验。实验中使用肥皂液的作用是。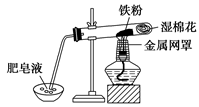
(3)如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精灯及其必要的仪器和物品,请在答题卷的方框中画出你设计的实验装置示意图(包括反应时容器中的物质)。
说明:①本题装置示意图中的仪器可以用下面的方式表示。
水槽: 试管:
试管: 蒸发皿:
蒸发皿: 玻璃导管:
玻璃导管: 或
或 (但应标示出在液面上或液面下)
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
(4)甲同学对实验后的黑色固体产物X含有哪些物质进行了如下实验:
| 实验步骤 |
实验操作 |
实验现象 |
| Ⅰ |
取少量黑色固体产物X(假定成分分布均匀)放入试管中,加入盐酸,微热。 |
黑色粉末逐渐溶解,有少量气泡产生。 |
| Ⅱ |
取实验Ⅰ反应后的溶液少许,滴加几滴KSCN溶液,振荡。 |
溶液没有出现血红色。 |
| Ⅲ |
取实验Ⅰ反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡。 |
高锰酸钾溶液褪色。 |
根据以上实验事实,能确定固体X中存在的物质是,但不能确定X的成分,原因是。
(5)乙同学为了探究实验后的固体产物是否存在Fe3O4设计下列实验方案:
①取固体样品m1 g,溶于足量的稀盐酸;
②向①反应后的溶液中加入足量H2O2的和氨水,充分反应后,过滤、洗涤、干燥;
③将②中所得固体进行灼烧,得到红棕色固体m2 g。
溶液X中发生氧化还原反应的离子方程式为;m1与m2的比值在范围内时,才能确定固体样品中一定存在Fe3O4。
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究SO2的漂白作用到底是SO2本身还是SO2与水作用的产物,某学习小组设计了如图装置来进行实验。请回答相关问题。
(1)制备SO2气体的反应方程式为:;
发生装置的玻璃仪器名称为、;
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。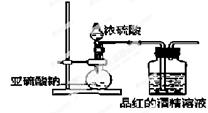
①;②;
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子)。
(4)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,对此他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确,其理由是。
(5)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,再分别一次性加入20ml0.1mol/L的Na2SO3溶液、20ml 0.1mol/L的NaHSO3溶液,发现加入Na2SO3溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“”内容:
| 同浓度溶液 |
SO32- |
HSO3- |
H2SO3 |
褪色速度 |
| Na2SO3溶液 |
多 |
少 |
少 |
快 |
| NaHSO3溶液 |
较上面_________ |
较上面_______ |
较上面_______ |
慢 |
②根据实验和分析,得出的结论是
氨气是一种化工原料。
(1)请写出工业上合成氨的化学方程式:
(2)实验室中,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。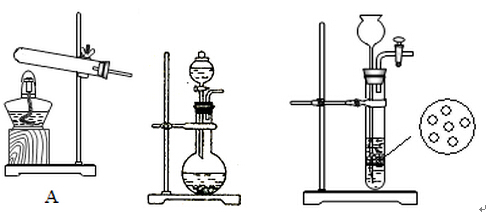
B C
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
反应的化学方程式为 ① |
|
| 乙小组 |
浓氨水、氢氧化钠固体 |
氢氧化钠的作用:氨水中存在平衡: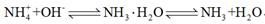 ,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动。 ,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动。 |
(3)请设计一个操作简单的实验,验证NH3·H2O是弱电解质。
。
(4)甲同学把制得的氨气溶于适量水中,得到稀氨水,用标准浓度的盐酸滴定,测定其浓度。实验步骤:准确量取10.00mL稀氨水于锥形瓶中,加入20mL水稀释,滴加溶液作为指示剂(填“石蕊”、“酚酞”或“甲基橙”),将(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至,停止滴定,记录数据。重复滴定2次。平均消耗盐酸Vml。计算原稀氨水的物质的量浓度
=(只列出算式,不做运算)
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
Fe2++ClO-+ = Fe(OH)3↓+ C1-+
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。