A.【化学—选修3.物质结构与性质】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为_____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为___________(填元素符号),其原因是____________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为___________________;分子中既含有极性共价键,又含有非极性共价键的化合物是______________(填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________________,乙___________;甲高温易转化为乙的原因是______________。
(5)这5种元素形成的一种1 :1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为_______________,该化合物加热时首先失去的组分是______________,判断理由是________________
下表是A、B、C、D、E五种有机物的有关信息: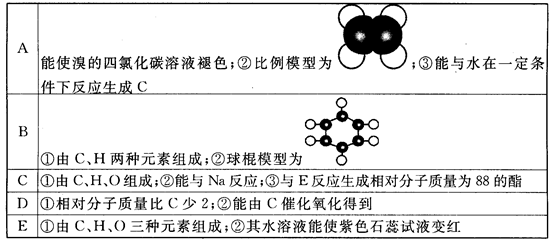
回答下列问题:
(1)A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)C催化氧化生成D的化学方程式为_________________。
(4)有机物B具有的性质是___________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:______________(用化学方程式说明)。
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。
(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____________。
(5)B与D所形成的化合物的化学键类型为______________。
(6)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_____________。
(7)实验室里除去BA2气体,可用下列试剂中的_____________(填字母)。
A.酸性高锰酸钾溶液B.浓硫酸
C.NaOH溶液D.NaHCO3溶液
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式___________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
(1)下列装置可用于吸收气体X的是 (填代号)。



(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为 。
②实验时,依次进行如下操作:组装仪器、 、加装药品、通入气体、 、点燃酒精灯。
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为 。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定剂 EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2-+ 2H+。则CuSO4·5H2O质量分数为________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。