某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
(4)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
(9分)如下图装置实验,A、B两烧杯分别盛放200 g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5 g(不考虑水的蒸发)。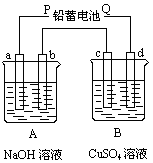
请回答下列问题:
(1)电源P极为 极;请分别写出b极和c极上发生的电极反应式:;
(2)c极上析出固体铜的质量为 g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 mol
(9分) 某化学反应2A(g)  B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
| 时间 实验序号 |
1 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800 ℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820 ℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为
mol•L-1•min-1。
(2)实验2中,A的初始浓度c2=mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3v1(填“>”“=”或“<”),且c3 =mol•L-1
(4)比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是。
(12分)化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据不合理的是______(填序号)。
A.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
B.用干燥的pH试纸测定浓硫酸的pH
C.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
D.用已知浓度盐酸滴定未知浓度氨水,用酚酞做指示剂。
(2) 某废水样品中含有一定量的Na+、CO 、SO
、SO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度。
的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1 KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,消耗KMnO4(H2SO4酸化)溶液体积Vml,计算。
①下列滴定方式中,最合理的是(夹持部分略去)________(填字母序号)。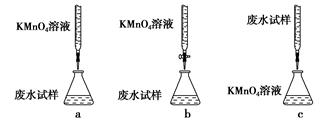
②达到滴定终点时现象是:。SO 的浓度的表达式为:。
的浓度的表达式为:。
(3) 已知反应: BeCl2+Na2BeO2+2H2O =" 2" NaCl+2Be(OH)2 ↓能进行完全, 据此判断下列叙述正确的是:
A、BeCl2溶液的 pH<7, 将其蒸干灼烧后得到的残留物为 Be(OH)2
B、Na2BeO2溶液的 pH>7, 将其蒸干灼烧后得到的残留物为 BeO
C、Be(OH)2既能溶解于盐酸, 又能溶解于 NaOH 溶液
D、Na2BeO2溶液中守恒关系有:C(Na+)+ C(H+)= 2c(BeO22-)+C(OH-)+C(H2BeO2)
E 、Li 、 Be 、 B 三种元素的第一电离能异常小的 B 元素。
(6分)已知某元素的原子序数排在氪元素的原子序数之前,当此元素的原子失去3个电子后,它的角量子数为2的原子轨道内,电子恰好为半充满,则该元素的名称 ,位于第 周期,第 族。
(18分)用“>”或“<”回答下列问题:
(1)酸性:H2CO3______H2SiO3,H2SiO3______H3PO4。
(2)碱性:Ca(OH)2________Mg(OH)2,Mg(OH)2______Al(OH)3。
(3)气态氢化物的稳定性:H2O________H2S,H2S______HCl。
由以上答案可以归纳出:
①元素的非金属性越强,其最高价氧化物的水化物的酸性越________。
②元素的金属性越强,其最高价氧化物的水化物的碱性越________。
③元素的非金属性越强,其对应的气态氢化物的稳定性越________。