在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法错误的是:
下列说法错误的是:



A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
D.改变温度可以改变此反应的平衡常数 |
下列反应的离子方程式正确的是
| A.硫酸与氢氧化钡在溶液中反应:Ba2++SO42- = BaSO4↓ |
| B.在NaOH溶液中加入醋酸溶液:H+ + OH- = H2O |
C.用小苏打治疗胃酸过多: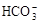 + H+ = CO2↑+H2O + H+ = CO2↑+H2O |
| D.向FeI2溶液中通入过量Cl2:2Fe2++Cl2 = 2Fe3++2Cl- |
下列说法中正确的是
| A.决定化学反应速率的主要因素是参加反应的物质的性质 |
| B.催化剂可以使不起反应的物质发生反应 |
| C.可以找到一种催化剂使水变成汽油 |
| D.催化剂是决定化学反应速率的主要因素 |
等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的是
| A.硝酸 | B.无水乙醇 | C.石灰水 | D.盐酸 |
能一次区分CH3CH2OH、CH3COOH、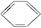 和CCl4四种物质的试剂是
和CCl4四种物质的试剂是
| A.H2O | B.NaOH溶液 | C.盐酸 | D.石蕊试液 |
下列说法正确的是
| A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 |
| B.分子组成符合CnH2n+2的烃一定是烷烃 |
| C.正戊烷分子中所有原子均在一条直线上 |
| D.碳氢原子个数比为1:3的烃有2种 |