全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
⑴地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式 。
⑵有效地开发利用CO2可以降低大气中CO2的含量,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。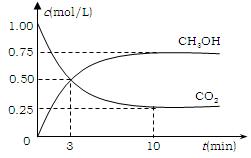
①从反应开始到平衡,氢气的平均反应速率
v(H2)=___________mol/(L·min);
②CO2的转化率= ;
③该反应的平衡常数为 (保留小数点后2位);
④ 下列措施中能使平衡体系中
下列措施中能使平衡体系中
n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1molCO2和3molH2 |
(10分)25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填“>”、“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)=mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (填“>”、“<”或“=”);
(5)将相同温度下相同浓度的四种溶液:
| A.NH3·H2O | B.NH4A | C.NH4HSO4 | D.NH4Cl按NH4+浓度由大到小的顺序排列(填序号) |
(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入,目的是;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是(填写序号);②中氯离子的浓度为mol·L-1。
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是(填写序号);②中氯离子的浓度为mol·L-1。
(10分)(1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b;
②若所得混合液的pH=2,则a∶b;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值___7,混和前c(NH3·H2O)__ c(HCl),氨水中c(OH-)_盐酸中c(H+)。(填>、<或=,下同)
肉桂醛在食品、医药、化工等方面都有应用。肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
(1)肉桂醛由C、H、O三种元素组成,质谱分析肉桂醛分子的相对分子质量为132,其分子中碳元素的质量分数为81.8%,肉桂醛的分子式是 。
肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原子,其结构简式是。(不考虑顺反异构与对映异构)
(2)已知:
I.醛与醛能发生反应,原理如下:
II.合成肉桂醛的工业流程如下图所示,其中甲为某种烃。
请回答:
①甲的结构简式是。
②丙和丁生成肉桂的化学方程式是。
(3)肉桂醛能被银氨溶液氧化,再经酸化得到肉桂酸,写出肉桂酸甲酯的结构简式。
(4)现用芳香烃A 为原料合成肉桂酸甲酯H的路线如下,测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰2︰1︰2。:
①化合物F中的官能团有 (填名称)。
②B→C的反应类型是 ,F→G的反应类型是 ,
③书写化学方程式
F→I
G→H
④G的同分异构体中,属于酯类目苯环上只有一个取代基的同分异构体有
种。其中任意一种的结构简式是
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量
分数是
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么
(2)选择的还原剂是否能用铁(填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是。