(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上 (填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上 (填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。图乙、图丙是一个将 能转化为 能的装置,人们把它叫做原电池。
(3)从上述现象中可以归纳出构成原电池的一些条件是 ;
有关的电极反应式:
锌片 ;铜片 。
36 g的H2O 和 60 g 的D2O 中, 它们所含有的原子总数之比为,分子内的中子总数之比为,若它们分别与足量的金属钠反应, 产生的气体的质量之比为。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断: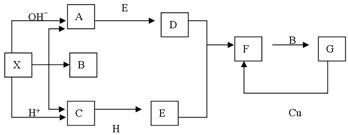
(1)化学式X;
(2)A的电子式为;空间构型;
C的结构式为;H所包含的化学键类型。
(3)工业上制取A的化学反应方程式;A→D的化学反应方程式;
C+H→E的化学反应方程式;G→D的离子反应方程式。
有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后变为无色溶液;在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀部分溶解并有气体放出,由此推断:
(1)原固体肯定有__________,(2)原固体肯定不存在_____________________。
(3)_____不能确定存在与否,要确定其存在,应进行的实验是___。
(1)(NH4)2SO4在强热条件下,可分解生成NH3、SO2、N2、H2O.
反应中氧化产物和还原产物的物质的量之比为。
(2)将K2S跟HNO3反应,生成NO、S、KNO3、H2O,反应的化学方程式为;氧化产物是;若生成2molNO,反应中电子转移的总物质的量为mol。
(1)浓H2SO4能够用于干燥某些气体,是由于它具有性;下列气体能用浓硫酸来进行干燥的气体是(可多选,但只要有选错项,即得0分)① Cl2② H2S③ NH3④ CO2
(2)浓H2SO4能使纸片变黑,是由于它具有性;
(3)浓H2SO4可以与Cu反应,是由于它具有 性和性,其反应的化学方程式是: 。