生活中常用的某种香料X的结构简式为: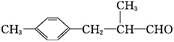
(1)香料X中含氧官能团的名称是 。
(2)香料X可发生的反应类型是 (填代号)。
a.酯化反应 b.还原反应
c.加成反应 d.消去反应
(3)已知: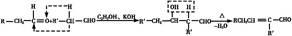
香料X的合成路线如下: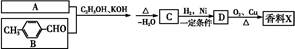
①A的结构简式是 。
②检验有机物C中含有碳碳双键所需用的试剂 。
a.银氨溶液 b.酸性高锰酸钾溶液
c.溴水 d.氢氧化钠溶液
③D→X的化学方程式为 。
④有机物B的某种同分异构体E,具有如下性质:
a.与浓溴水反应生成白色沉淀,且1 mol E最多能与4 mol Br2反应
b.红外光谱显示该有机物中存在碳碳双键
则E的结构简式为 。
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
下图:
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=;反应的平衡常数随温度的变化如表一,
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡后CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g) H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有(填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有(填实验编号);
| 实验编号 |
N(CO) |
N(H2O) |
n(H2) |
N(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
0.5 |
2 |
1 |
1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
①体系的压强不再发生变化②混合气体的密度不变③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变⑤体系的温度不再发生变化⑥ v(CO2正)= v(H2O逆)
(4)图表示该反应此流程的第II步反应在时刻t 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为: CH4(g)+H2O(g)=3H2(g)+CO(g)△H="-103.3" kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为。
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如右图所示,请观察此图回答:
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=" +" 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
| A.反应①中反应物的总能量高于生成物的总能量 |
| B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g)中的化学键所释放的能量 |
| C.CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1 |
| D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1 |
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5 kJ的热量,试写出合成塔中发生反应的热化学方程式。
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如右图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是,负极反应为:。
现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为,用离子方程式说明溶液呈碱性的原因;
(3)实验中滴定曲线如右图,在B点,a 12.5(填大于、小于或等于)在C点各离子浓度由大到小排序。
有机化学知识在生活中应用广泛。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
①下列有关说法中,正确的是;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上。写出
葡萄糖发生银镜反应的化学方程式:。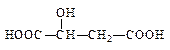
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为,该分子中官能团的名称为,可以和醇类物质发生反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为。
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)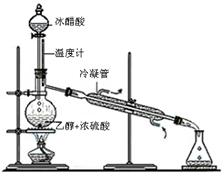
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号);
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。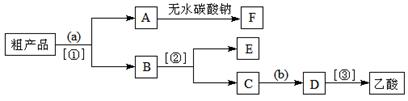
试剂a是,分离方法①是;分离方法②是,试剂b是;
④写出C → D 反应的化学方程式。
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl =" NaCl" + H2O,
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A.B.。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是(填“锌”或“铜”),发生反应(填“氧化”或“还原”);
②正极的电极反应式为;
③产生这些气体共需转移电子mol。