下图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为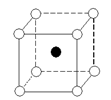

高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO—+4OH—=2FeO42—+3Cl—+5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是()
| A.高铁酸钠中铁显+6价 |
| B.湿法中FeO42—是氧化产物 |
| C.干法中每生成1mol Na2FeO4转移4mol电子 |
| D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是
| A.Na+、H+、Cl-、NO3- | B.Na+、Mg2+、Cl-、SO42- |
| C.K+、Ba2+、OH-、I- | D.Cu2+、CO32-、Br-、ClO- |
下列离子方程式与所述事实相符且正确的是 ( )
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O =HClO+HCO3- |
B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl- 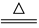 Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3 =2FeO42-+3Cl-+H2O+4H+
下列反应最终能生成Fe3+的化合物的是()
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2 ④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
| A.①②③ | B.①③⑤ | C.③④ | D.③⑤ |
下列图示实验正确的是()
