SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程中,下列说法中不正确的是
| A.上述过程中,最终被还原的是NO3-- |
| B.从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 |
| C.上述过程中,会产生一种无色无味的难溶于水的气体 |
| D.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1∶1 |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA |
| B.白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA |
| C.5.6 g铁粉在2. 24 L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D.常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是
| A.含0.1 mol.L-1SO2的溶液中:Na+、Ba2+、Br-、Cl- |
| B.能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO3-、SO42- |
C.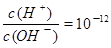 的溶液中:K+、NH4+、SO42-、NO3- 的溶液中:K+、NH4+、SO42-、NO3- |
| D.不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
聚苯乙烯塑料在生产、生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取:
下列有关苯乙烯的说法正确的是
| A.分子中含有5个碳碳双键 | B.属于不含极性键的共价化合物 |
| C.分子式为C8 H10 | D.通过加聚反应生成聚苯乙烯 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.常温常压下,11.2L氯气含有的分之数为0.5NA |
| B.常温常压下,1mol氮气含有的质子数为7NA |
| C.在标准状态下,22.4LH2O含有的原子数目为3NA |
| D.32gO2所含原子数目为2NA |