某校化学研究性小组,利用下列提供的实验装置和试剂对某种燃煤所含元素进行定性和定量检测,试回答: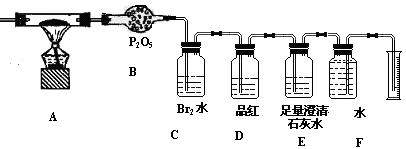
(1)将燃煤充分燃烧,产生气体经化学分析主要含有CO2、H2O、SO2、N2四种气体
(2)称取该燃煤样品Wg,通入纯氧使其充分燃烧,检测该燃煤中所含上述元素的质量分数。利用下列装置进行实验:
①指出上述装置中D、E的作用
D , E
为了测得相应数据,进行如下操作(忽略CO2在C、D中的溶解)
a.实验前用托盘天平称得B、C、D、E的质量分别为W1、W2、W3、W4
b.实验完成后称得B、C、D、E的质量分别为m1、m2、m3、m4
c.通过正确实验操作,用F装置测得收集气体体积为V L
②为了准确测量F中收集到的气体体积,正确的实验操作是
③测定燃煤中的硫的质量分数,当观察到溴水不完全褪色,品红不褪色时,燃煤中含硫元素的质量分数的表达式为 。当观察到
现象时,无法测定燃煤中硫元素的质量分数。
CaCO3广泛存在于自然界,是一种重要的化工原料。某大理石主要成分为CaCO3,另外有少量的不溶于水的亚硫酸盐。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。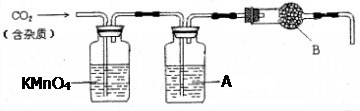
完成下列填空:
(1)用100 mL浓盐酸配制1:1(体积比)的稀盐酸时,需要用量筒量取水mL
(2)为了检验CO2气体中的某种杂质气体有无除尽,上述装置中,A是溶液。
(3)上述装置中,B物质是。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的类,为了将石蜡从饭盒中溶出,应选用下列试剂中的。
a.氯化钠溶液b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式。
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。
研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+=Cu + Cu2+ + H2O;
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO至溶液的pH为4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH至溶液的pH为7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子,为验证存在该阳离子,可选用的试剂为,对应的现象是。
(4)Ⅳ中加NaClO的目的是。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1:;组合2:;组合3:(用化学式表示)
用含少量铁的氧化物的氧化铜制取硫酸铜晶体(CuSO4·xH2O)。有如下操作: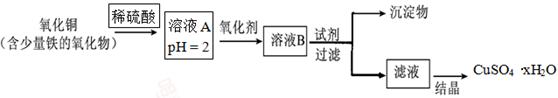
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为(填编号,下同)。
a.KMnO4b.(NH4)2Sc.NaOHd.KSCN
(2)欲用(1)中选择的检验试剂测定溶液A中的Fe2+的浓度,下列滴定方式中(夹持部分略去),最合理的是(填序号)。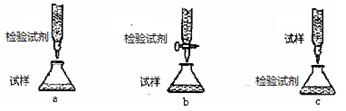
写出滴定反应的离子方程式 。
⑶在上述流程中,要得到较纯的产品,试剂可选用。
a.NaOH
b.FeO
c.CuO
d.Cu(OH)2
e.Cu2(OH)2CO3
⑷为了测定制得的硫酸铜晶体(CuSO4·xH2O)中 的值,某兴趣小组设计了实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为ng。据此计算得
的值,某兴趣小组设计了实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为ng。据此计算得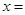 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题。
(1)试管B中饱和食盐水的作用;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为,试管D中的气体检验方法为_________________ 。
(14分)氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.已停止实验时,应先停止通入H2,后停止加热。
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化。该小组甲同学对反应后的固体产物成分提出如下假设。
假设l:含有Ca 和CaH2。
假设2:含有CaH2和CaO。
假设3:含有。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| 取少量固体样品,… |
(4)定量实验测定Ca 和CaH2 混合物中CaH2的质量分数。
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在时进行收集(填字母)
a.刚开始有气泡时b.气泡连续均匀时 c.气体经过验纯后,再收集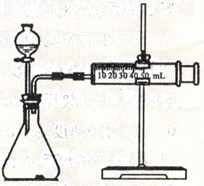
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数(天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是。