Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题。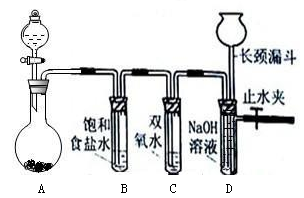
(1)试管B中饱和食盐水的作用 ;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是 ;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为 ,试管D中的气体检验方法为________________ _ 。
(本小题15分)根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H) -Mr(E) =34,又知C焰色反应火焰呈黄色。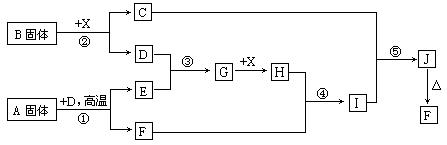
(1) 反应②的化学方程式:__________________________________;
产物C的电子式:_______________________。
(1)化合物A中所包含的化学键有:_______________________。
(2)反应④的离子方程式:_______________________________。
反应⑤的化学方程式:__________________________________。
(3)已知每生成16g E,放出106.5 kJ热量,则反应①的热化学方程式为:
_________________________________________________________ 。
(本小题15分)已知一定条件下丙烯的浓HBr能发生如下反应:
CH3-CH=CH2 + H-Br CH3--CH3
化合物A和A’互为同分异构体,元素分析含溴58.4%(其它元素数据不全,下同)。A和A’有如下系列反应,其中气态物质B是烃,含碳85.7%;C’不发生类似图中C的系列转化;E为酸性物质,其中碳氢含量共为63.6%。
请回答下列问题:
(1)写出结构简式:A,B:。
(2)写出下列转化关系的化学方程式:
①B→A’ :。
②C→D:。
③D→E:。
(3)简述检验A中含有溴元素的实验方法:
。
A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
(1)写出下列物质的化学式:A______,B______,C______。
(2)写出下列反应的化学方程式:
E―→F________________________________________________________________________;
G―→H________________________________________________________________________;
D的浓溶液与木炭反应的方程式:________________________。
(3)检验某溶液中是否含D中阴离子的方法是______________________。
侯氏制碱法的步骤如下图所示: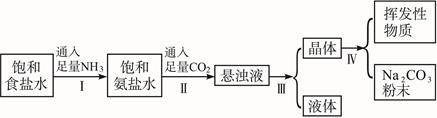
试完成下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合物,则I和Ⅱ的总反应式是________________。
(2)由这一反应可知NaCl比NaHCO3溶解度________________。
(3)操作I、Ⅱ不能颠倒的原因是 ________________。
(4)Ⅲ的操作叫 ________________;Ⅳ的操作叫 ________________________。
已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是
________________________________。
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。〔可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸〕
| 实验步骤 |
实验现象 |
反应离子方程式和结论 |
注:实验步骤的序号由你顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。