(14分)氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是 。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.已停止实验时,应先停止通入H2,后停止加热。
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化。该小组甲同学对反应后的固体产物成分提出如下假设。
假设l:含有Ca 和CaH2。
假设2:含有CaH2和CaO。
假设3:含有 。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| 取少量固体样品,… |
|
(4)定量实验 测定Ca 和CaH2 混合物中CaH2的质量分数。
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在 时进行收集(填字母)
a.刚开始有气泡时 b.气泡连续均匀时 c.气体经过验纯后,再收集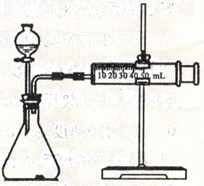
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数 (天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是 。
芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理: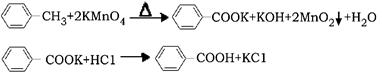
反应试剂、产物的物理常数:
| 名称 |
相对分 子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
易溶 |
易溶 |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下:
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。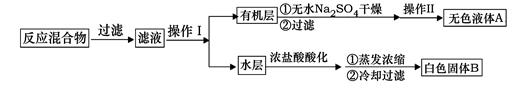
(1)无色液体A的结构简式为。操作Ⅱ为。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是。
(3)下列关于仪器的组装或者使用正确的是。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入,分液,水层再加入,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为。
(13分)根据要求完成下列各小题实验目的。(a、b 为弹簧夹,加热及固定装置已略去)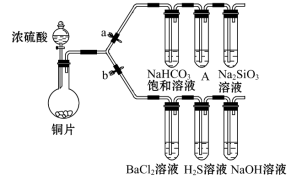
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸 >碳酸)
①连接仪器、、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是__________________,装置A中的试剂是。
③能说明碳的非金属性比硅强的实验现象是:_______________________。
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是:___________。
②若大量的SO2通入NaOH溶液中,其化学方程式是:__________________。
③BaCl2溶液中无沉淀现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯 水 |
氨 水 |
| 沉淀的化学式 |
写出其中SO2显示还原性并生成沉淀的离子方程式___________________。
某实验小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
①用25 mL NaOH溶液吸收CO2气体,至CO2气体不再溶解;
②小火煮沸溶液1 min~2 min;
③在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合。此方案能制得较纯净的Na2CO3(第一步的实验装置如下图所示)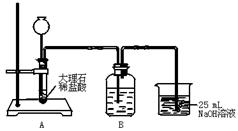
(1)写出①、③两步的化学反应的离子方程式①。③。
(2)装置B中盛放的试剂是,作用是。
(3)实验室中吸收尾气的方法很多。如下图装置中可以用来吸收氨气的是。
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
I、酸性条件下,锡在水溶液中有Sn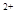 、Sn
、Sn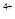 两种主要存在形式,Sn
两种主要存在形式,Sn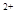 易被氧化。
易被氧化。
Ⅱ、SnCl2易水解生成碱式氯化亚锡[Sn(OH)C1]。
回答下列问题:
(1)操作1的步骤为、、过滤、洗涤、干燥。对沉淀进行洗涤的方法是。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式及化学反应原理解释原因:。
(3)加入Sn粉的作用有两个:①调节溶液pH;②。
(4)SnSO4还可在酸性条件下用作双氧水的去除剂,发生反应的离子方程式是:。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取质量为m的锡粉溶于稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c的K2Cr2O7标准溶液滴定生成的Fe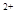 (已知酸性环境下Cr2O
(已知酸性环境下Cr2O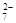 可被还原为Cr
可被还原为Cr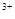 ),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是。(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)
),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是。(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)
利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。据此回答: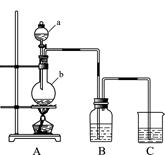
(1)C中的试剂是;仪器b的名称为,b中发生反应的离子方程式为。
(2)写出新制饱和氯水中含有氯元素物质的化学式:。氯水长时间放置,氯水中的成分就会发生变化,能快速判断氯水中含有较多C12的方法是:。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字补充:
①氯水与NaOH反应,碱性减弱红色褪去。②。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
【实验步骤】
①取上述实验后试管内的无色溶液3 mL盛于另一支洁净的试管中;②,振荡试管。
【现象与结论】
①若,则证明溶液红色褪去的原因是①而不是②。
②若,则证明溶液红色褪去的原因是②而不是①。(5)为了从新制氯水中制得较高浓度的HClO,可向氯水中加入的试剂是。
| A.CaCO3 | B.NaHSO3 | C.Na2CO3 | D.Ca(OH)2 |