葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
Fridel—Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:Ar+RX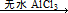 ArR+HX△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
ArR+HX△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示: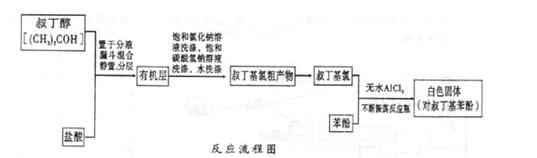
试回答下列问题:
(1)实验装置烧杯中漏斗的作用是________。
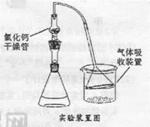
(2)巳知Fridel—Cxafts反应是放热反应,为防止叔丁基氣的蒸气被大量的HCl气体带走而影响产率,应将锥形瓶置于_______(填“冷水浴”或“热水浴”)中。
(3)有机层中加入饱和氣化钠溶液及饱和碳酸氢钠溶液的作用可能是_______。通过操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯。
(4)某同学因去掉该制备装置中的氣化钙干燥管,发现产率很低(观察不到对叔丁基苯酚白色固体)且锥形瓶中有大量的白雾,他推测是作催化剂的AlCl3发生强烈水解所致,该同学设计如下实验方案进行验证,请完成下表内容。
| 实验方案 |
实验现象 |
能否说明水解 |
| ①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液 |
||
| ②将充分冒白雾后的液体抽滤,得不溶性固体,将固体分成两份, 。 |
两份固体均溶解 |
(5)若上述同学称取了9.4g苯酚与适量叔丁基氯反应,从反应液中提取出对叔丁基苯酚,将其配成100mL乙醇溶液,移取25.00mL溶液,滴定,消耗NaOH物质的量为5×10-4moL,则以苯酚为基准计算对叔丁基苯酚产率的表达式为_______。
碘元素有“智力元素”之称。研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量。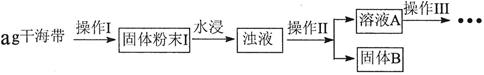
(1)操作I为灼烧,则灼烧时用____盛装海带,操作II为____________________________;
(2)水浸时通常要将悬浊液煮沸2~3min,目的是______________________________;
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
[推测]:①以IO3ˉ形式存在;②以Iˉ形式存在
[查阅资料]:IO3ˉ具有较强的氧化性,I2+2S2O32ˉ=2Iˉ+S4O62ˉ
将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II |
无现象 |
|
| ② |
往试管I中加入______ |
无现象 |
证明不是以IO3ˉ形式存在 |
| ③ |
往试管II中加入_______ |
_______________ |
证明以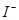 形式存在 形式存在 |
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将Iˉ氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为___________,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量_________________.(假设操作I、II过程中碘不损失,相对原子量I-127)
草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________;假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L-1盐酸、3% H2O2、0.1 mol•L-1CuSO4、20% KSCN、蒸馏水。
| 实验步骤 |
现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 |
若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ |
__________________________________ ___________________________________ |
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g样品中:n(Fe2+)=; n(C2O42-)=;FeC2O4的质量分数为 (精确到0.01%,FeC2O4的式量为144)
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:__________________,漂白粉的有效成分为。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 |
|
| 步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 |
现象: 结论: |
| 步骤3:取滤液分装A、B两支试管。向A试管, |
现象:溶液先变红色,然后褪色。 结论: |
| 步骤4:向B试管, |
现象:产生白色沉淀。 结论: |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为______________。(只列算式,不做运算,已知:Mr[Ca(ClO)2]="143" ;Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
某同学从报刊上了解到菠菜中富含可溶性草酸盐和碳酸盐,决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元有机酸,还是一种还原性较强的物质,如2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,草酸钙(CaC2O4)不溶于水和醋酸,能溶于强酸:CaC2O4+2H+= H2C2O4+Ca2+。
(1)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成实验步骤、预期现象和结论。
限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HCl、0.1 mol·L-1 NaOH、1 mol·L-1 CaCl2、0.01 mol·L-1 KMnO4、澄清石灰水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 |
|
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 |
出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, |
|
| 步骤4: |
(2)要准确测定菠菜中草酸盐含量,请回答有关问题:
① 操作:取m g菠菜样品,将其中草酸盐转化为CaC2O4沉淀分离出来,用盐酸溶解后,将溶液转入_________中加水配制成100mL溶液。每次用_____________移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。
② 计算:菠菜中草酸盐(以C2O42-计)的质量分数为___________________。(只列式不计算。C2O42-的化学式量为88)
③ 讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液,结果可能偏高,原因是。