(10分,每空2分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。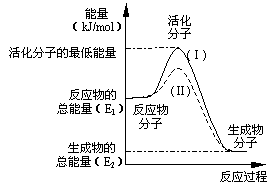
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________________。
结构的研究是有机化学最重要的研究领域,某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构)。
为推测X的分子结构,进行如下图转化: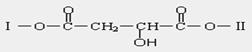
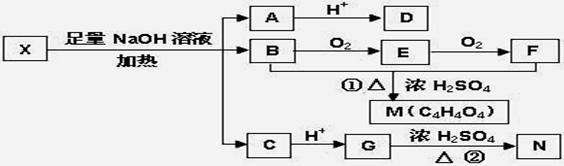
已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号。M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应。请回答:
(1)D不可以发生的反应有(选填序号)_____________;
①加成反应②消去反应③氧化反应④取代反应
(2)写出上图转化中生成 M的化学方程式:_________________________________________________
(3)已知向X中加入FeCl3溶液,能发生显色反应,写出X的一种结构简式:__;1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH___________mol。
(4)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。写出W的可能结构简式_____ ___。
物质A有如下反应路线: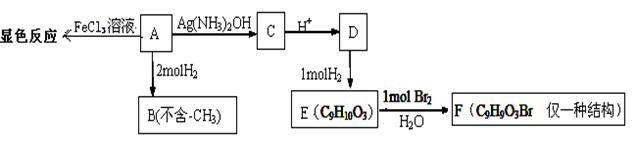
(1)1mol 物质A最多能消耗H2的物质的量为
(2)A→C的化学方程式为;
(3)H、G与B互为同分异构,且满足下列条件:①H、G与浓溴水和NaHCO3都不反应,且结构中均不含有-CH3(官能团不能同时连在同一个碳原子上)。②1molH、G 都能与2molNa反应。③H环上一氯取代只有2种,G环上一氯取代只有3种。H的结构简式为;G的一种结构简式为。
(4)已知在一定条件下R1CH=CHR2 → R1CHO+ R2CHO,A在一定条件下氧化生成羧酸X、Y。
X是芳香族化合物,Y是一种还原性的二元羧酸。
写出X在浓硫酸条件下的缩聚反应方程式。
有甲、乙、丙三种物质:


甲乙丙
(1)关于乙下列叙述正确的是
a.1mol该有机物在加热和催化剂作用下,最多能和2molNaOH反应
b.该有机物能使酸性KMnO4溶液褪色
c.该有机物的分子式为C9H11Cl
d.该有机物在一定条件下,能发生消去反应、取代反应、氧化反应和还原反应
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):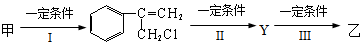
① 反应Ⅰ的反应条件是_________________________________________
②其中反应II的化学方程式是
(3)由甲出发合成丙的路线之一如下:
写出反应③的化学方程式__________________________________________________
②写出丙的结构简式_________________________
为测定某有机化合物X的结构,进行如下实验:
(1)取一定量有机物X在氧气中完全燃烧,测得生成8.8g CO2和3.6g H2O,消耗标准状况下的氧气5.6L,则X中含有种元素。
(2)用质谱仪测得A的相对分子质量为44,则X的分子式为。
(3)根据价键理论,试写出X可能的结构简式(不考虑含有 结构的物质)。
结构的物质)。
(4)X的核磁共振氢谱中出现两个不同位置的峰,则X与氢气反应的化学方程式是。
按要求完成下列问题:
①某高分子有机物 是由一种单体缩聚而成的,该单体的键线式为
是由一种单体缩聚而成的,该单体的键线式为
②将少量水杨酸(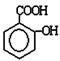 )滴入Na2CO3溶液中发生的化学方程式:______________________
)滴入Na2CO3溶液中发生的化学方程式:______________________
③CH2ClCOOCH2CH3与NaOH的水溶液共热:
④有机物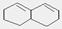 在较高温度下和Br2 按物质的量之比1:1发生加成反应的化学方程式。
在较高温度下和Br2 按物质的量之比1:1发生加成反应的化学方程式。