物质A有如下反应路线: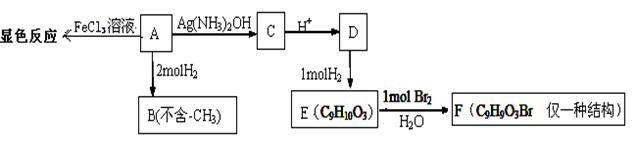
(1)1mol 物质A最多能消耗H2的物质的量为
(2)A→C的化学方程式为 ;
(3)H、G与B互为同分异构,且满足下列条件:①H、G与浓溴水和NaHCO3都不反应,且结构中均不含有-CH3(官能团不能同时连在同一个碳原子上)。②1molH、G 都能与2molNa反应。③H环上一氯取代只有2种,G环上一氯取代只有3种。H的结构简式为 ;G的一种结构简式为 。
(4)已知在一定条件下R1CH=CHR2 → R1CHO+ R2CHO,A在一定条件下氧化生成羧酸X、Y。
X是芳香族化合物,Y是一种还原性的二元羧酸。
写出X在浓硫酸条件下的缩聚反应方程式 。
臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝,同时产生O2,则:
(1)该反应的化学方程式为:;
(2)该反应中氧化剂的名称为,还原产物的化学式为;
(3)若消耗0.1 mol氧化剂,反应中转移电子的物质的量为__________________。
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):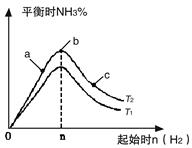
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):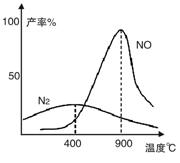
4NH3+5O2 4NO+6H2O 4NH3+3O2
4NO+6H2O 4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是___________________
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。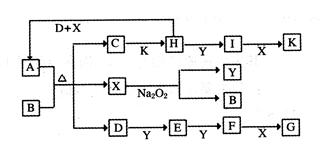
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为:______,A的结构式为__________,A分子的空间构型是_______;
(2)写出②中涉及反应的化学方程式_____________________________________。
(3)由B反应生成1 molA放出的热量为46.2kJ,写出该反应的热化学方程式,并注明反应条件____________________________________________________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式_______________________________________,生成的大量白烟属于_______化合物。
某原电池构造如下图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是___________________________。OH-离子移向_______(填“A”或“B”)中的溶液。Cu为原电池的______极,其电极反应式是_____________________________。A中的电解质溶液在该电池工作一段时间后会出现_______________________的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。