.随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂可以水解成葡萄糖,再将葡萄糖转化为乙醇,用做燃料。
(1)写出绿色植物的秸秆转化为乙醇的化学方程式:
①____________________________________
②________________________________________。
(2)乙醇除用做燃料外,还可以用它合成其他有机物,以乙醇为起始原料的转化关系如图所示:(已知;在有催化剂的条件下,多步氧化R-CH2OH→R-CHO→RCOOH)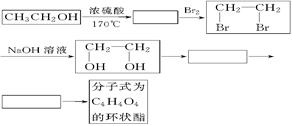
请在方框中填上相应物质的结构简式。
(3)写出上面转化关系图中由CH2OHCH2OH―→C4H4O4的化学方程式(有机物用结构简式表示)。
阅读下表中部分短周期主族元素的相关信息:
请回答:
| 元素代号 |
相关信息 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期的所用金属离子中,Y的离子半径最小 |
| Z |
Z与Y同周期,是所在周期中原子半径最小的元素 |
| T |
T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为,该化合物中所含的化学键有(填化学键名称)。
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
、。
已知强酸与强碱反应的中和热为—57.3KJ/mol,请写出硫酸溶液与氢氧化钠溶液反应的中和热的热化学方程式。
常温下,有下列三种溶液:①0.1 mol/L NH4Cl②0.1 mol/L NH4HCO3③0.1 mol/L NH4HSO4
请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是:
(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②③﹝填“>”、“<”或“=”)
甲醇是一种优质的液体燃料,CO和CO2均可用于合成甲醇。
目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g)△H1
(1)已知:2CO(g) +O2(g) =2CO2(g)△H2
2H2(g)+O2(g) =2H2O(g)△H3
则CO(g) + 2H2(g)  CH3OH(g)的△H=。
CH3OH(g)的△H=。
(2)由CO合成甲醇时,CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
(3)
一定温度下,向2L密闭容器中加入1mol CH3OH (g),发生反应:CH3OH(g)  CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)=。
CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)=。
该温度下,CO(g) + 2H2(g)  CH3OH(g)的平衡常数K=。
CH3OH(g)的平衡常数K=。
相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.CH3OH的平衡浓度 c.达到平衡的时间 d.平衡时气体的密度
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。
①充入CH3OH的电极为极;
②负极反应的电极反应式为。
.Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)
①连接仪器、、加药品后,打开a,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是:
。
③从品红溶液中观察到的现象说明SO2具有性。
④高锰酸钾溶液中的实验现象是。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
| 编号 |
实验操作 |
预期现象和结论 |
| 步骤① |
有白色沉淀生成,证明待测液中含SO42-。 |
|
| 步骤② |
||
| 步骤③ |
||
| …… |