甲醇是一种优质的液体燃料,CO和CO2均可用于合成甲醇。
目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
(1)已知:2CO(g) +O2(g) =2CO2(g) △H2
2H2(g)+O2(g) =2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)由CO合成甲醇时,CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(3)
一定温度下,向2L密闭容器中加入1mol CH3OH (g),发生反应:CH3OH(g)  CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)= 。
CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)= 。
该温度下,CO(g) + 2H2(g)  CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.CH3OH的平衡浓度 c.达到平衡的时间 d.平衡时气体的密度
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。
①充入CH3OH的电极为 极;
②负极反应的电极反应式为 。
(本题共12分)
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ∙mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 ="-534.2" kJ·mol-1
写出肼和N2O4反应的热化学方程式;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为。
Ⅱ、一定质量的液态化合物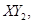 在标准状况下的一定质量的
在标准状况下的一定质量的 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为: ===
=== 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56  则:
则:
(1)反应前 的体积是。 (2)化合物
的体积是。 (2)化合物 的摩尔质量是。
的摩尔质量是。
(3)若 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为和(写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为和(写元素符号)。
(本题共14分)5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
已知: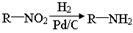
(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为。
(2)5—氨基酮戊酸盐中含氧官能团的名称是,C→D的反应类型为。
(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式。
(4)写出D→E的反应方程式。
(5)已知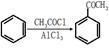 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、 为原料合成
为原料合成 单体的合成路线流程图(无机试剂任选)。
单体的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下:
。
(本题共10分)有机物M(C15H16O8)在酸性溶液中水解得A、B、C三种物质,A在170 ℃与浓硫酸混合加热,可得到一种具有催熟果实作用的气体D,A在一定条件也可以氧化成C。请回答下列问题:
(1) 300多年前,著名化学家波义耳发现了铁盐与B的显色反应,并由此发明了蓝黑墨水。用B制造墨水主要利用了类化合物的性质。(填代号)
A.醇 B.酚 C.酯 D.羧酸
(2) M与NaOH反应的方程式是。
(3) B与丙醇反应得到的酯具有抗氧化作用,是目前广泛应用的食品添加剂.其结构简式为;C的同分异构体有(包括C)种。
(4)写出由A生成D的化学反应方程式:
(本题共12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀盐酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②③两个实验有关的离子方程式:
②________________________________;③_____________________________________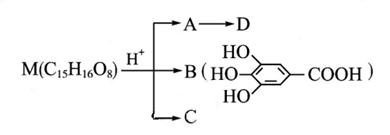
燃料电池是一种新型的无污染、无噪音、高效率的发电设备,是一种很有发展潜力的新能源,它主要由燃料、氧化剂、电极和电解质组成,燃料电池的结构和传统电池一样具有正负电极,正负电极被电解质分隔,它以还原剂(用氢作燃料)为负极反应物,以氧化剂(如空气中的氧气等)为正极交换物,在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
(1)燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:负极______________;正极______________.
(2)氢氧燃料电池可作为载人航天器的首选电池,一个重要原因是它在产生持续电流的过程中生成的产物是水,这正好解决航天员的饮水问题,航天员饮用这些合成水通过消化系统,大部分在被___________吸收.