氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。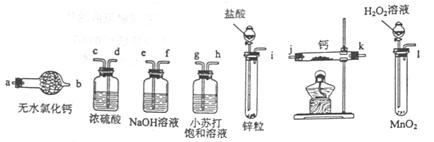
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式___________________;
②该同学的判断不正确,原因是_________________;
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象___________;
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
纳米TiO2在涂料、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。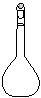
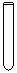
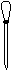

a b c d e
(2)滴定终点的现象是___________________________________________________。
(3)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使配制结果______________。
②若在配制标准溶液过程中,俯视液面,使测定结果_________。
我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
配制500 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为________。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将________(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为________________________________________________________________。
假定最终称得小烧杯的质量为__________(填“32.6 g”或“31.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示)。
| 砝码质量/g |
50 |
20 |
20 |
10 |
5 |
| 称量(取用砝码过程) |
标尺
(3)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是________。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2)在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下: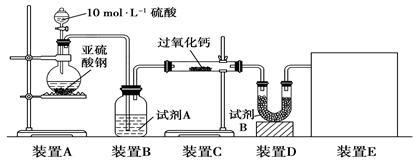
(1)试剂A可以选用________,试剂B的作用是________。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V——m1关系式。
未被氧化:____________,部分被氧化:____________,
完全被氧化:____________。
若SO2完全被氧化,写出反应的化学方程式:___________________________。
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:________________________________________________________。
实验探究:
(4)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:______
_____________________________________________________________。
实验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:___________________________________________________________。
三苯甲醇(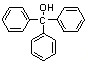 )是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
)是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
图1
已知:(1)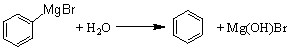 (碱式溴化镁);
(碱式溴化镁);
(2)相关物质的物理性质如下:
| 物质 |
熔点 |
沸点 |
溶解性 |
| 三苯甲醇 |
164.2℃ |
380℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 |
-116.3℃ |
34.6℃ |
微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 |
-30.7°C |
156.2°C |
不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 |
-34.6°C |
212.6°C |
不溶于水 |
| Mg(OH)Br |
常温下为固体 |
能溶于水,不溶于醇、醚等有机溶剂 |
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:A,导管B的作用;
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是,微沸回流时冷凝管中水流的方向是
(填“X→Y”或“Y→X”),装有无水CaCl2的仪器A的作用是;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写空白:


图2图3
(4)抽滤时所用装置如图3所示,该装置存在的错误有,抽滤完毕或中途停止抽滤时的操作方法:应先,然后;
(5)洗涤液最好选用,检验产品已经洗涤干净的操作为。
(A)水(B)乙醚(C)乙醇(D)苯