工业上以A为主要原料来合成乙酸乙酯,其合成路线如下图所示。其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平。又知2CH3CHO+O2 2CH3COOH。请回答下列问题:
2CH3COOH。请回答下列问题: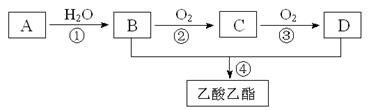
(1)写出A的电子式 。
(2)B、D分子内含有的官能团分别是 、 (填名称)。
(3)写出下列反应的反应类型:① ,④ 。
(4)写出下列反应的化学方程式:
① ;
② ;
④ 。
除去下列物质中所含有的杂质(括号内为杂质),将选用的试剂及分离方法填在题后的横线上,涉及化学反应的并写出有关反应的化学方程式(是离子反应的,写出其离子方程式)。
(1)Fe2O3[Fe(OH)3]________,__________________;
(2)FeCl3溶液(FeCl2)________,______________________;
(3)Fe(Al)___,_______________________。
(4)CO2(SO2),。
(5)SiO2(Al2O3),。
(6)淀粉溶液(氯化钠)。
(7)KNO3(NaCl)。
(8)Br2(H2O)。
(12分)含有下列离子的五种溶液①Ag+②Mg2+③Fe2+④Al3+⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是________(填离子符号,下同)。
(2)向③中加入NaOH溶液,现象是______________________________,
有关方程式(是离子反应的写离子方程式)为__________________。
(3)加入过量NaOH溶液无沉淀的是_____________。
(4)加入铁粉若溶液质量增重的是_______,若溶液质量减轻的是_______________。
(5)遇KSCN溶液呈红色的是______________。
(6)能用来鉴别Cl-存在的离子是_______________。
(12分)国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是________(选填序号).
| A.SO42- | B.NO3- | C.Cl- | D.CO32- |
(2)检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是________,铝元素发生变化的离子方程式是______________________.
(3)为了回收废液中的金属银,某同学设计了如下方案: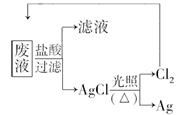
若依该方案获得银108 g,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气________L.
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。
根据卤代烃的相关性质,回答下列问题:
I.(1)由异丙苯( )制备对溴异丙苯需要的反应物(写名称)是,反应条件是。
)制备对溴异丙苯需要的反应物(写名称)是,反应条件是。
(2)α﹣甲基苯乙烯( )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)
II.有机物M是一种重要的化工原料,已知M分子式为C7H14O2,1mol M最多消耗46g金属钠。M 可通过下列路线合成(某些反应的反应物和反应条件未列出):
(1)按要求写出结构简式:AC
(2)写出反应④的化学方程式:④;
(3)⑥的反应类型是___________;
(4)写出M中所含官能团的名称。
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线: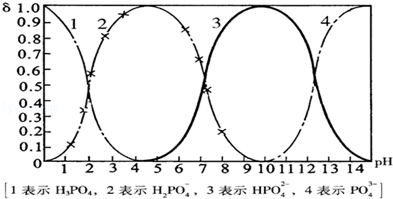
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为.当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是.
(3)从图中推断NaH2PO4溶液呈性(填“酸”、“碱”、或“中”),其原因是.
(4)在Na3PO4溶液中,c(Na+)/c(PO43-)3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是。