10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
| A.Ba(OH)2溶液 | B.BaCl2溶液 |
| C.NaOH溶液 | D.澄清的石灰水 |
(2)将加热后的溶液冷却到10℃,若溶液的pH________8.3(填“大于”“小于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。
(16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g)∆H1="a" kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g)∆H2="b" kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=kJ∙mol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K=。
③关于上述反应,下列叙述不正确的是(填编号)。
| A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快 |
| B.缩小容器的体积,平衡将向右移动 |
| C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂 |
| D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆 |
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。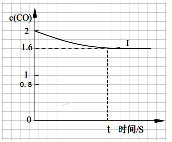
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是。
对乙烯基苯甲酸是重要的医药中间体,广泛应用于合成感光材料。对乙烯基苯甲酸可通过如下反应合成。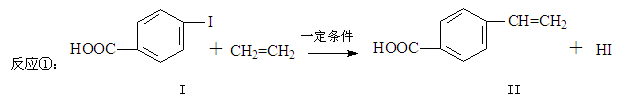
(1)下列关于化合物I和化合物II的说法,正确的是______。
| A.化合物I能与新制的Cu(OH)2反应 |
| B.均可发生酯化反应和银镜反应 |
| C.化合物II能使KMnO4溶液褪色 |
| D.1mol化合物II最多能与5 mol H2反应 |
(2)化合物II的分子式为____________,化合物II在催化剂条件下生产高分子化合物的反应方程式。
(3)化合物II可由芳香族化合物Ⅲ通过消去反应获得,Ⅲ和Cu共热的产物能发生银镜反应,写出化合物Ⅲ的结构简式;
(4)化合物IV是化合物II的同分异构体,且化合物IV遇FeCl3溶液显紫色,苯环上的一氯代物只有2种,写出化合物IV的结构简式(写一种)。
(5)利用类似反应①的方法,仅以溴苯(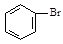 )和乳酸(
)和乳酸(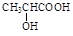 )为有机物原料合成化工原料肉桂酸(
)为有机物原料合成化工原料肉桂酸(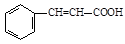 ),涉及的反应方程式为。
),涉及的反应方程式为。
【选修5—有机化学基础】
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M.与NaOH溶液反应后的产物,其一氯代物只有一种。
请回答:
(1)B、F的结构简式分别为____________、____________
(2)反应①〜⑦中,属于消去反应的是________(填反应序号)。
(3)D发生银镜反应的化学方程式为_______________________;反应⑦的化学方程式为________________________
(4)A的相对分子质量在180〜260之间,从以上转化中不能确认A中的某一官能团,确 定该官能团的实验步骤和现象为________________________________________
(5)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
【选修3—物质结构与性质】
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为。
(2)X、Y原子的第一电离能大小顺序为。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为,中心原子的杂化轨道类型为。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。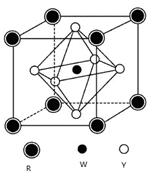
则该矿物的化学式为,若已知该晶胞的边长为a cm,则该晶胞的密度为g/cm3。(用含a、NA的代数式表示)
【选修2—化学与技术】实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: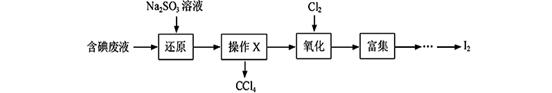
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为;该操作将I2还原为I-的目的是。
(2)操作X的名称为。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为。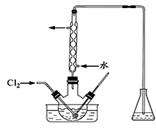
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
①阳极的电极反应式为。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为。