元素A、B、C是元素周期表中短周期的三种元素,请根据表中信息回答下列问题。
| 元素 |
A |
B |
C |
| 性质结构信息 |
单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同。 |
单质是带有金属光泽的灰黑色固体,是信息技术的关键材料。 |
最高价氧化物的水化物 与其气态氢化物反应得到离子化合物D。 与其气态氢化物反应得到离子化合物D。 |
(1)写出B在元素周期表的位置__________。
(2)C的气态氢化物的电子式__________,检验D中阳离子的实验方法是______________。
(3)D的水溶液呈_________(填“酸性”、“碱性”或“中性”),其原因用离子方程式表示为________________________。
有机物A的结构简式为: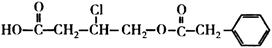
(1)A的分子式为_______________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗____________________mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为_______。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体。
______________________________________________________________________
某市中学化学兴趣小组利用下图所示原电池装置进行实验,请回答下列问题: 
(1)实验中,同学们发现两装置电流计的指针偏转方向不同,因此有人提出以下观点,其中正确的是____________。(双选题,漏选得2分,多选错选得0分)
| A.金属活动性铝比镁强 |
| B.金属活动性镁比铝强,两装置中镁均为负极 |
| C.仅根据金属活动性顺序不能准确判断原电池的正负极 |
| D.原电池中的正负极受电解质溶液的酸碱性、强氧化性等因素的影响 |
(2)要准确判断原电池的正负极除了可用电流计等仪表测量外,还可以通过观察现象来判断,请写出乙图中的电极材料及反应现象。(设镁铝均为纯净金属)
正极:负极:。
(3)写出甲图中的电极反应式:
①负极:_________________________;
②正极: ___________________。
(4)乙图中铝片与NaOH溶液反应的离子方程式为___________________________________。某同学测得乙图中实验前铝片的质量是5g,实验后的质量是2.3g,则在实验过程中产生氢气的体积为_______(标况),转移电子的物质的量为________。
在某一容积为2 L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示: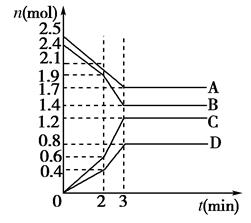
回答下列问题:
(1)该反应的化学方程式为___________________________________________;
(2)反应开始到2 min,用D的浓度变化表示的化学反应速率为________;
(3)在2 min时,图象发生改变的原因可能是_______________________(用字母表示)
A. 升高温度 B.加入稀有气体,增大压强
C.减少A的物质的量 D.加入催化剂
(4)下列叙述能说明上述反应达到平衡状态的是
A.混合气体的总质量不再变化 B.混合气体压强不再变化
C.v正(B)︰v逆(C)=5︰6D.消耗1mol A的同时生成1mol D
分别完全燃烧①1molCH4、②1molC2H4、③1molC6H6,生成的水相等的是; 需要的氧气最多的是。(填序号)
化学式为C8Hn的烷烃,m值等于;CnH22的烷烃,n值等于;相对分子质量为212的烷烃的分子式为。