(18分)(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于分解反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于化合反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.(NH4)2SO3 2NH 2NH 3↑+H2O+SO2↑ 3↑+H2O+SO2↑ |
B.2CO+O2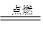 2CO2 2CO2 |
C.2C+SiO2 Si+2CO↑ Si+2CO↑ |
D.NH4NO3 N2O+ 2H2O N2O+ 2H2O |
E.CaCO3 + CO2+ H2O=Ca(HCO3)2
F.MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(2)根据反应Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②被还原的硝酸与未被还原的硝酸的物质的量比是________。
③用单线桥表示此反应转移的电子数目及方向。
用系统命名法命名下列物质(共6分)
①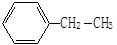 ②
② 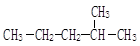 ③
③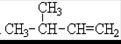
实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是(空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
化合物SOCl2是—种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOC12,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:_________________________
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是_________________________________________________。
相同条件下pH=3的盐酸和pH=3的醋酸:
(1)取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者_________后者;
(3)各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者__________后者。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: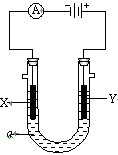
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为。在X极附近观察到的现象是。
② Y电极上的电极反应式为,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。