现有K 、O、S、H 四种元素,选用其中一种或几种元素可组成符合下列要求的物质(酸、酸性氧化物、盐、X)。
(1)完成下列转化:(用化学方程式表示)
①酸 → 盐:  ;
;
②酸性氧化物 → 盐: ;
(2)X在水溶液中电离成K+ 、H+、SO42-,则X的化学式为 ,X属于 (填序号)
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(3)设计两种实验方案(指出使用的试剂或方法) 鉴别Na2SO4和X:
鉴别Na2SO4和X:
方案1: 。
方案2: 。
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
已知:
请写出NO与CO反应生成无污染气体的热化学方程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温”、“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,
当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。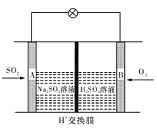
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。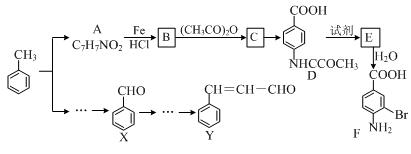
已知:①


②2CH3CHO  CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
(2)C→ D的反应类型是 。
(3)B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子
②分子中含有 -CHO
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是 (填序号).
(2)①是________ ______ (填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________ 。
F1的结构简式是________________ 。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________ 。
合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和X,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是(填“热塑性”或“热固性”)_________塑料,写出X与足量新制的Cu(OH)2悬浊液反应的化学方程式:
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,则这两种单体的化学式是为___________________,______________________。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: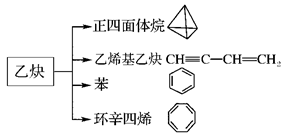
(1)正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法正确的是________。
| A.能使酸性KMnO4溶液褪色 |
| B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反应的化学方程式为
(4)写出与苯互为同系物且一氯取代产物只有两种的物质的结构简式
(举两例):__________________、__________________。