可用于分离或提纯物质的方法有:
| A.分馏 | B.盐析 | C.过滤 | D.重结晶 E.升华 F.渗析 G.电解 H.加热分解 I.蒸馏 J.灼热氧化 |
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)从石油中分离出汽油和煤油等成分________;
(2)除去淀粉溶液中的少量碘化钠________;
(3) 从油脂皂化反应的混合液中分离出高级脂肪酸钠________;
从油脂皂化反应的混合液中分离出高级脂肪酸钠________;
(4)除去粗铜中锌、银等 金属________;
金属________;
(5)除去水中的Na+、SO、Cl-等杂质________;
(6)除去KNO3晶体中混有的少量N aCl________.
aCl________.
NH3和NOx在催化剂作用下可转变为N2和H2O,这是目前硝酸厂尾气治理所普遍采用的一种方法,为了提高NO的转化率实际操作中用过量的氨气。某研究小组拟验证NO能被氨气还原并计算其转化率。(已知:浓硫酸在常温下不氧化NO气体)。
(1)装置③可以选的干燥剂为:_________(选填序号,下同);
a.浓硫酸b.碱石灰 c.无水氯化钙
(2)若实验室只提供浓氨水和生石灰两种试剂,你会选择下图_____装置来制取氨气;下图装置C中盛放固体药品的仪器名称是_____。
(3)写出装置⑤中反应的化学方程式_______;该反应中的氧化剂是______。
(4)实验室在用装置D制取较纯NO过程中,先在试管中加入2~3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用__________。
(5)实验完成后,检验装置⑥中NH4+的存在需要浓NaOH溶液和__________试纸。
(6)已知NO与FeSO4溶液反应形成棕色可溶性的[Fe(NO)]SO4,装置⑥中,小段玻璃管的作用是_____;装置⑦的作用是除去NO和检验氨气是否除尽,若氨气未除尽观察到的实验现象是_____。
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。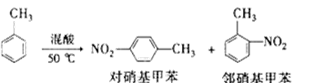

实验中可能用到的数据:
| 密度/g∙cm-3 |
沸点/℃ |
溶解性 |
|
| 甲苯 |
0.866 |
110.6 |
不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 |
1.286 |
237.7 |
不溶于水,易溶于液态烃 |
| 邻硝基甲苯 |
1.162 |
222 |
不溶于水,易溶于液态烃 |
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许________,目的是____________________。
(2)冷凝管的作用是_________;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是________,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下: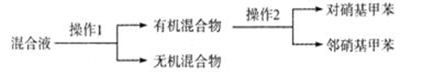
其中,操作1的名称为________,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和________________、_________________。
(5)该实验中一硝基甲苯的产率为________(保留三位有效数字)。
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3 Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4 Fe3+ + 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是。
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是。
(6)灼烧:准确称取所得CoC2O4 1.470 g,在空气中充分灼烧得0.830 g氧化钴,写出氧化钴的化学式。
以炼铅厂铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)为原料生产氯化锌的工艺流程如下:
(1)“酸浸”时一般控制温度为30 ℃,温度不宜过高的原因是。
(2)“氧化”时需控制溶液的pH为5。写出KMnO4氧化Fe2+为Fe3+的离子方程式。实际生产中高锰酸钾用量远多于理论用量的原因是。
(3)物质A的化学式是。
(4)写出流程中省略的操作步骤:,若操作不当则会产生杂质Zn(OH)Cl,欲降低产品中该杂质的含量,可以采取的方法是。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 |
SnS沉淀完全 |
FeS开始沉淀 |
FeS沉淀完全 |
|
| pH值 |
3.9 |
1.6 |
3.0 |
5.5 |
(1)操作II中,先通入硫化氢至饱和,目的是;后加入硫酸酸化至pH=2的作用是。
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②。
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知酸性KMnO4被FeSO4还原时生成Mn2+。写出该测定过程的离子反应方程式:;
②滴定时盛放KMnO4溶液的仪器为(填仪器名称)。
③判断此滴定实验达到终点的方法是。
④若实验操作无失误,测得上述样品中FeSO4·7H2O的含量仍偏低,则可能的原因是:。