(7分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是_________________热反应,这是由于反应物的总能量____________生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量_______________________形成产物的化学键放出的总能量。
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2 g氢气燃烧时放出286 kJ热量,而每千克汽油燃烧时放出的热量为46000 kJ。试据此分析氢气作为能源代替汽油的优势:_______________________________。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是____________ (填“a电极”或“b电极”),在负极发生的电极反应是_________________,
(共9分)在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________;
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(10分)五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是___________(用化学式表示)。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)。
④X与Z能形成一种离子化合物,用电子式表示其形成过程:________________________。
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体, 它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)生成物NF3中氮原子的轨道杂化方式为,NF3分子空间构型为;键角109°28′(填“大于” “小于” “等于”) 。
(2)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式。
(3)某元素X跟氟可形成离子晶体,其晶胞结构如图,该离子化合物的化学式为(用X、F表示);X阳离子的配位数为。
(4)若晶胞边长为a cm,该离子化合物的摩尔质量为M g/mol,则该晶体的密度为g· cm-3(用a、M、NA表达)。
I.(6分) 已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g) 在427℃时, 当一氧化碳和水蒸气的起始浓度都为0.01mol/L时, 一氧化碳的转化率为50%。
CO2(g)+H2(g) 在427℃时, 当一氧化碳和水蒸气的起始浓度都为0.01mol/L时, 一氧化碳的转化率为50%。
(1)该反应在427℃时的平衡常数K =。
(2)温度不变时,若起始时一氧化碳浓度仍为0.01mol/L, 水蒸气的起始浓度为0.02mol/L,此时一氧化碳的转化率为(用百分数表示,百分数中保留一位小数)。
(3)在保持温度和压强不变时向平衡体系中充入氩气,一氧化碳的转化率(填“增大”“减小”“不变”)。
(4)在保持温度和容器体积不变时向平衡体系中充入氩气,一氧化碳的转化率(填“增大”“减小”“不变”)。
II.(8分)某温度下,取一定质量的硫酸铜溶液,用石墨作电极进行电解,当阳极产生0.025mol的气体时,CuSO4恰好被完全电解,得密度为1.2g/cm3的溶液100mL,求:
(1)电解后所得溶液的pH =。
(2)电解前所取CuSO4溶液的质量为克。
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入的物质为(写化学式),质量为克。
(18分)某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。利用下图所示装置可以验证元素的非金属性的变化规律。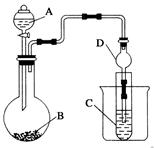
(1)仪器A的名称为,仪器D的作用是________________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫的:________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为___________。
(3)若要证明非金属性:C>Si,则A中应加入________,B中应加入Na2CO3,C中应加入____________溶液,观察到C中的现象为______________________。