四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________
(4)Y的最高价氧化物的水化物与其氢化物反应的离子方程式 。
以硫 铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: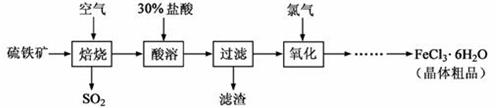
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整:+ Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 ;
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,这些反应的离子方程式为 ;。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高 的金属元素。
的金属元素。
回答下列问题:
⑴M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l:3构成分子A,A的电子式为_________;Y、L两元素按原子数目比l:2构成分子B,B的结构式为____________,B分子中的化学键属于_______键。
⑶硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子结构示意图为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol·L-1b.+29.7 kJ·mol·L-1
c.-20.6 kJ· mol·L-1d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出在阳极生成R及一种气体的电极反应式:_________________;
R受热分解生成化合物Q,由R生成Q的化学方程式:______________________;生成化合物Q的用途________、_____(写两种)。
现有NaCl、Na2SO4、NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀和固体,从而实现阴离子的分离。相应的实验过程可用下图所示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X :,沉淀A:,沉淀B:。
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO 3需进行的实验操作是(填操作名称)。
3需进行的实验操作是(填操作名称)。
用双线桥表示下列反应中得失电子的情况,并指明氧化剂、还原剂、氧化产物、还原产物:
3FeO + 10HNO3 ="==" 3Fe(NO3)3+ NO↑ + 5H2O
()()()()
其中,氧化性:__________ > ___________;还原性:___________ > ___________
 胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反
胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反 应的离子方程式:__;如果病人同时患胃溃疡,为防胃壁穿孔,最好用含氢氧化稆的胃药(如胃舒平),反应的离子方程式为:。
应的离子方程式:__;如果病人同时患胃溃疡,为防胃壁穿孔,最好用含氢氧化稆的胃药(如胃舒平),反应的离子方程式为:。