电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图
|


(每空1分,共5分)对于混合物的分离或提纯,常用到的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3颗粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3颗粒。
(2)碳酸钠易溶于水,不易分解,从其水溶液中得到碳酸钠晶体,可采用 的方法。
(3)提取碘水中的碘,用 方法。
(4)淡化食盐水,可采用 的方法。
(5)除去氧化钙中的碳酸钙可用 的方法。
2012年8月,英国《每日邮报》报道制造太阳镜、婴儿奶瓶、太空杯和光盘的主要材料都是聚碳酸酯,聚碳酸酯在一定条件下可释放出有毒的双酚A(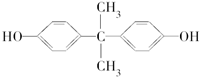 )。聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
Ⅰ.下列关于双酚A的说法不正确的是________(填序号)。
A.利用聚碳酸酯制成的茶杯来泡茶时对人体无害
B.双酚A的分子式是C15H16O2
C.双酚A的核磁共振氢谱显示有4组峰,且峰面积之比为1∶2∶2∶3
D.1 mol双酚A最多消耗2 mol Br2
Ⅱ.聚碳酸酯(简称PC)是分子链中含有碳酸酯基的高分子聚合物,其合成流程如下: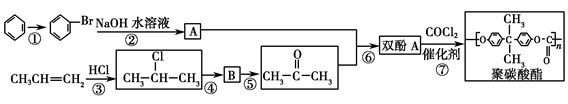
(1)反应①②③④⑤中属于取代反应的有________。
(2)有机物A的结构简式为_________________________________。
(3) 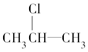 按系统命名法的名称为________。
按系统命名法的名称为________。
(4)CH3CH=CH2与Cl2加成产物的同分异构体有________种(不含加成产物)。
(5)反应⑥的另一产物为________。
(6)写出反应⑤⑦的化学方程式:
反应⑤_________________________________________________________。
反应⑦________________________________________________________,
该反应的反应类型为____________________________________________。
金刚烷(可以看成四个等同的六元环组成的空间构型)是一种重要的化工原料,工业上
可通过下列途径制备: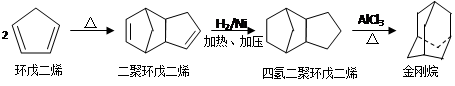
请回答下列问题:
(1)环戊二烯分子中最多有____________个原子共平面;
(2)金刚烷的分子式为_______________,其分子中的—CH2—基团有__________个;金刚烷的二氯代物的数目是______。
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: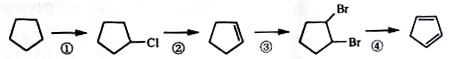
其中,反应①的产物名称是_________________,反应②的反应试剂和反应条件_____________,反应③的反应类型是___________;
A B C
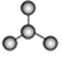
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称 。
②该有机物的同分异构体的核磁共振氢谱中应有 个峰。
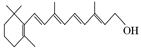
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为 。
②1 mol维生素A最多可与 mol H2发生加成反应。
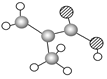
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为
②该物质中所含官能团的名称为 和
有机物分子HO—CH2CH = CHCH2—COOH含有多种官能团;
⑴写出其中一个官能团的名称
⑵它能与金属钠反应生成含钠的化合物和H2,写出含钠的化合物的结构简式
⑶它能在浓H2SO4存在下与酸或醇或自身分子间发生多种形式的酯化反应,写出它跟乙酸或它跟乙醇反应生成的酯的结构简式 ,(只写一个)浓H2SO4的作用是 。(写主要的作用)