现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。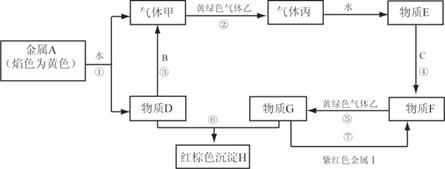
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的离子方程式:
写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
实验室检验物质D中阳离子的方法是
(4)分析反应,3H2O2 + 2H2CrO4= 2 Cr(OH)3 + 3O2 + 2H2O
该反应中的还原剂是___ ________,,还原产物是______ ____;
若该反应转移了0.3mol电子,则产生的气体在标准状态下体积约为_____ ___。
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C=CHCH3 |
10.4 |
| CH3CH=CH2 |
2.03 |
| CH2=CH2 |
1.00 |
| CH2=CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
| A.(CH3)2C=C(CH3) 2 | B.CH3CH=CH CH3 |
| C.CH2=CH2 | D.CH2=CHCl |
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3 + HBr → CH3CHBrCH3 + CH3CH2CH2Br
(主要产物) (次要产物)
|
CH2="CH" CH2CH3 + H2O → CH3CH(OH)CH2CH3 + CH3CH2CH2 CH2 OH
(主要产物) (次要产物)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。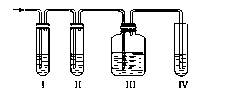
(1)写出实验室制乙烯的反应方程式:
(2)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ___________;Ⅱ___________;Ⅲ___________;Ⅳ:浓溴水(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性KMnO4溶液 |
(3)能说明二氧化硫气体存在的现象是_______________________________。
(4)确证含有乙烯的现象是_________________________________________。
(5)写出Ⅳ中发生反应的化学方程式:。
写出下列有机物的结构简式:
(1)2,6-二甲基-4-乙基辛烷:;
(2)2-甲基-1-戊烯:;
(3)有A、B、C三种烃,它们的结构简式如下图所示: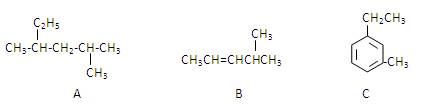
A的名称是;B的名称是;
C的名称是。
选择下列某种答案的序号, 填入下表的空格
①同位素②同素异形体③同分异构体④同系物⑤同种物质
| 物质 |
丁烷与 |
红磷 |
氯仿与 |
氕与 |
新戊烷与 |
| 名称 |
2--甲基丙烷 |
与白磷 |
三氯甲烷 |
氘、氚 |
2,2--二甲基丁烷 |
| 相互 |
|||||
| 关系 |
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为 ▲。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 ▲。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下: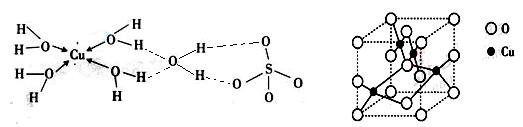
下列说法正确的是 ▲(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 ▲。
酞菁也是常见的配位体,结构如右图。该分子中氮原子杂化方式为 ▲。 写出与硫酸根离子互为等电子体的分子和离子各一种 ▲、 ▲。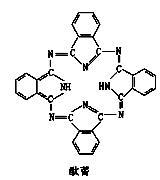
(5)Cu2O的熔点比Cu2S的 ▲(填“高”或“低”),
请解释原因 ▲。