A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称) ,以下三种说法中,可以验证该结论的是(填写编号) ;
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为 。
(3)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方 程式如下:
程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+ 5Cl 2↑+8H2O
5Cl 2↑+8H2O
⑴此反应中氧化剂是,氧化产物。若有1mol KMnO4参加反应,转移电
子的物质的量为。
⑵15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为,有molHCl
发生反应,有molHCl被氧化。
⑶若此盐酸的密度为1.2g/cm3,其物质的量浓度为。
⑴同温同压下,同体积的H2和CO2物质的量之比为,原子个数之比为,质量比为(最简整数比)。
⑵用化学用语表示下列过程:
用离子方程式表示铝粉与氢氧化钠溶液的反应
用化学方程式表示铁和水蒸气的反应,并用双线桥标出电子转移的方向和数目
用离子方程式表示钠与水的反应,并用单线桥标出电子转移的方向和数目
(13分)有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:
已知B的相对分子质量为60,分子中只含一个甲基。
C的结构可表示为: (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为_____________。
(2)官能团—X的名称为_______________;高聚物E的链节为____________。
(3)A的结构简式为__________________________。
(4)反应⑤的化学方程式为____________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式___________。
ⅰ.含有苯环 ⅱ.能发生银镜反应ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
(9分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件,Ph—代表苯基 )。
)。
(1)下列说法不正确的是________(填字母)。
A.反应①、④属于取代反应
B.化合物Ⅰ可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)。
(3)反应③的化学方程式为______________________(要求写出反应条件)。
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体 。该同分异构体的分子式为________,结构式为_
。该同分异构体的分子式为________,结构式为_ _________________。
_________________。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NC—CCl3反应成功合成了该物质。下列说法正确的是________(填字母)。
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4―→C+6N2↑
下表是A、B两种有机物的有关信息: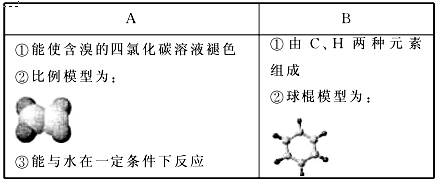
 根据表中信息回答下列问题:
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称为________________;
写出在一定条件下,A与水反应的化学反应方程式___________。
(2)A的同系物用通式Cn Hm表示,B的同系物用通式Cx Hy表示,当A、B同系物分别出现同分异构体时,碳原子数最小值n =________,x =________。
(3)B具有的性质是______________(填序号)。
①无色无味液体;②有毒;③不溶于水;④密度比水大; ⑤与酸性KMnO4溶液和溴水反应使之褪色;⑥任何条件下不与氢气反应;⑦使溴水颜色变浅或褪色