从下列事实所列出的相应结论合理的是 ( )
| A.SO2的水溶液可以导电说明是SO2电解质 |
| B.常温下白磷可自燃而氮气须在放电时才与氧气反应说明N的非金属性大于P |
| C.某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH4+ |
| D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-或HCO3- |
设NA代表阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,1.12LSO3所含的原子数是0.2NA |
| B.3.9gNa2O2吸收足量的CO2时转移电子数是0.05NA |
| C.20g重水中含有中子数为8NA |
| D.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA |
下列依据相关实验得出的结论正确的是
| A.向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32- |
| B.向某溶液中滴加氯水,再加入KSCN溶液,溶液变红,该溶液中一定含有Fe2+ |
| C.向某溶液中通入Cl2后,溶液变黄,继续加淀粉溶液,溶液变蓝,说明原溶液中有I- |
| D.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(部分产物已略去),下列说法错误的是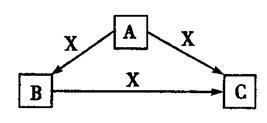
A.若X为Cl2,则C可能为Fe
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为C
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
将一定量的铁粉完全溶解于某浓度的硝酸中,反应后收集到NO2和NO的混合气体,下列说法正确的是
| A.反应后生成的盐只有Fe(NO3)2 |
| B.反应后生成的盐只有Fe(NO3)3 |
| C.反应后生成的盐为Fe(NO3)2和Fe(NO3)3 |
| D.以上三种情况都有可能 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.酸性溶液中:Fe2+、ClO-、SO42-、Na+ |
| B.pH=13的无色溶液中:K+、NO3-、Al3+、CO32- |
| C.澄清透明溶液中:Fe3+、Ba2+、Na+、Cl- |
| D.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42- |