新华网酒泉9月20日电:由我国独立研制的“长征”系列运载火箭是中国航天的主力运载工具,自1996年10月以来,已连续进行366次成功发射。若某火箭推进器中的燃料是液态偏二甲基肼[(CH3)2N—NH2],氧化剂是N2O4,发生的反应可写为:(CH3)2N—NH2+2N2O4===3N2↑+2CO2↑+4H2O↑。下列有关说法不正确的是( )
| A.火箭点火后瞬间,逸出红棕色气体是NO2 |
| B.偏二甲基肼[(CH3)2—N—NH2]与均二甲基肼[CH3NH—NH—CH3]沸点不相同 |
| C.每生成3 mol氮气,转移电子的物质的量为16 mol |
| D.在宇宙飞船船舱中比在地球上更容易做过滤实验 |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是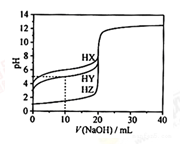
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-6 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时: c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+) |
| D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-) |
在体积恒定的密闭容器中,一定量的SO2与1.00mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2 2SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%。下列有关叙述正确的是
2SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%。下列有关叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.达到平衡时,O2的转化率是31.5% |
| C.达到平衡时,SO2的转化率是31.5% |
| D.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是: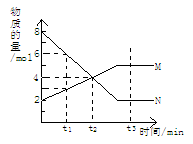
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
对于可逆反应mA(g)+nB(g) pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ~t图象如下图:
pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ~t图象如下图: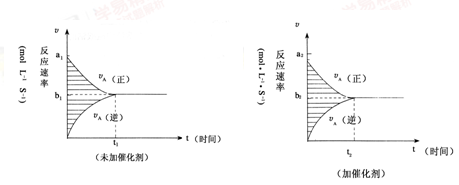
如下关系正确的为 ()
①a1=a2②a1<a2③b1=b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑧ |