(8分)(2011·扬州调研)在2 L密闭容器中反应2NO2(g) 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是( )
| A.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:反应容器的体积缩小了 |
| B.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:使用效率更高的催化剂 |
| C.实验Ⅰ条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数 |
| D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应 |
(2)若实验Ⅰ中NO2的起始浓度改为1.2 mol·L-1,其他条件不变,则达到平衡时所需用的时间________40 min(填“大于”、“等于”或“小于”),NO2的转化率将________(填“增大”、“减小”或“不变”)。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1 ∶1组成的NO2与NO混合气体(保持温度不变),则平衡将________移动,新平衡状态时NO2的物质的量浓度为________mol·L-1。
(4)若将实验Ⅲ所得的平衡混合气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气________L。(设空气中N2与O2体积比4 ∶1)
以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液 中加入适量的对苯二酚等物质,其目的是 ▲。
中加入适量的对苯二酚等物质,其目的是 ▲。
(2)下列有关说法正确的是 ▲。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 ▲。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 ▲。
(1)三聚氰胺(结构如右图),由于其含氮量高被不法奶农添加到牛奶中 来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。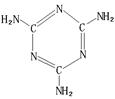
三聚氰胺中C原子的杂化形式是
二种环境的N原子的杂化形式分别是,。
(2)化合A是一种不稳定的物质,它的分子式可表示为OxFy,10mL A气体能分解成为15mL O2和10mL F2(同温同压)
①A的分子式是;
②已知A的分子中的x个氧原子呈…O-O-O…链状排列,则A的电子式是,A分子的结构式是。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++x R-H→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经测定,即可求出x和n,确定配离子的组成。
将含0.0015mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/L NaOH溶液25.00ml,推知:
x=,n=,该配离子的化学式为。
2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有 单键。
单键。
(1)该氮氢化合物的结构式为。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,写出该反应的化学方程式。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出
上述氮氢化合物通入足量盐酸时,发生反应的化学方程式。
下表为元素周期表的一部分,请参照元素A-H在表中的位置,
族 周期 周期 |
IA |
0 |
||||||
| 1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
B |
C |
D |
|||||
| 3 |
E |
F |
G |
H |
用化学用语回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。
(2)B、C、D的第一电离能由大到小的顺序为_________________________。 (3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。 (4) E、F的最高价氧化物的水化物相互反应的离子方程式
(4) E、F的最高价氧化物的水化物相互反应的离子方程式 。
。
(5)在B所形成的化合物CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ;
与CO分子互为等电子体的分子和离 子分别为 和 ,根据等电子理
子分别为 和 ,根据等电子理
论推测CO分子的结构式可表示成 ,一个CO分子中有 个σ键, 个л键。
(6)根据VSEPR理论预测D和H所形成的HD4— 离子的空间构型为______________型。
(7)由A、B、C、D、E元素组成的10电子粒子中,含配位键的有、;
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D <E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)B的氢化物的分子空间构型是。其中心原子采取杂化。
(2)写出化合物AC2的电子式。AC2是由键组成的(填“极性”或“非极性”)分子。
(3)E的外围电子排布式是,在形成化合物时它的最高化合价为, ECl3形成的配合物的化学式为。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是。