室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.醋酸的电离程度增大,C(H+)亦增大 |
| B.再加入10ml pH=11的NaOH溶液,混合液pH=7 |
| C.溶液中导电粒子的数目减少 |
D.溶液中 不变 不变 |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr) = 7.7×10-13,Ksp(Ag2CrO4) =9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,
下列与反应原理相关的叙述不正确的是
| A.装置Ⅰ的溶液若换为稀硝酸,则腐蚀过程与原装置不同 |
| B.装置Ⅱ在反应结束时溶液中存在Fe2+ |
| C.装置Ⅰ中不可能发生如下反应:Fe+2Fe3+=3Fe2+ |
| D.装置Ⅱ中的铁丝能发生电化学腐蚀 |
下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,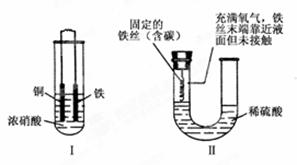
下列叙述正确的是 ( )
| A.装置Ⅰ在反应过程中自始至终只生成红棕色气体 |
| B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀 |
| C.装置Ⅱ在反应过程中能产生氢气 |
| D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+ |
现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是()
| A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2=V3 |
| B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1 =V2<V3 |
| C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1=V2=V3 |
| D.若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大 |
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,其它条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,其它条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )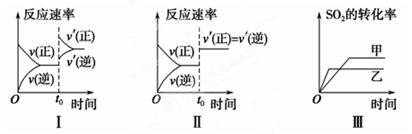
| A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 |
| B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |