根据下列实验装置图回答(装置用代号表示)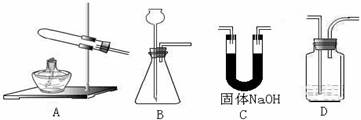
①实验室制氧气时,应选用的发生装置是 ;制氢气时应选用的发生装置是 ,制二氧化碳时应选用的发生装置是 ,检验二氧化碳气体可选用D装置,其装置中盛放的试剂一般是 。
②用锌粒和浓盐酸反应制氢气,将制成的气体通入硝酸银,有白色沉淀,说明氢气中含有(写化学式) ,反应方程式为 ,若要制出纯净的氢气,除发生装置外还应选用的一种装置是 ;该装置中药品的作用是 。
甲、乙两同学拟用实验确定某酸HA是弱电解质。他们设计的方案(理论方案)分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=3的两种酸溶液各100 mL;
②分别取这两种溶液各1 mL,加水稀释为100 mL;
③用两支试管分别取相同体积的两种稀释液,同时加入纯度相同、颗粒大小均等的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是。
(2)甲方案中,能说明HA是弱电质的理由是测得溶液的pH___1(选填“>”、“<”、“=”)。
(3)关于pH试纸的使用方法,下列叙述正确的是。
a.pH试纸在使用之前应用蒸馏水润湿
b.将pH试纸直接插入待测溶液,取出后再与标准比色卡对比
c.pH试纸测出的数值应该保留一位小数
d.能使pH试纸显红色的溶液显酸性
(4)乙方案中,说明HA是弱电解质的现象是。
已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
请回答:
(1)A中的现象,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向(填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为,升高温度,该反应中NO2的转化率将(填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是;
②一段时间后气体颜色又变浅的原因是;
③由此实验得出的结论是 。
(2)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是;在此过程中,该反应的化学平衡常数将(填“增大”、“减小”或“不变”,下同),NO2的转化率将。
(5分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;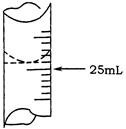
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
0.22 |
26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位);
(3)下列哪些操作会使测定结果偏高(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。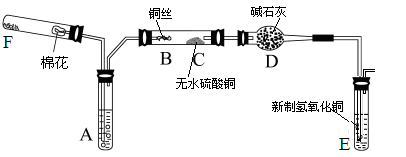
(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)___。
(2)B处发生的化学反应方程式为________________。
(3)C处应出现的现象是_________________,
D处使用碱石灰的作用是__________________,
E处应出现的实验现象是 _____________________,
F处可以添加的固体药品是 ______________。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出。由此推断此时B处发生反应的化学方程式为______________。
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数:
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是。
(2)反应①和②分别在装置和中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是_____,优点是用量少,缺点是__________。
(4)反应②为_____(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是。
(5)中和釜D中加入的Z最适宜的是(填编号)
a.NaOHb.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为和,判断的依据是。
(7)用该方法合成苯酚和丙酮的优点是。