Fe3O4一种黑色粉末,又称磁性氧化铁,它的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
▲提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. ______________________________。
▲设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
⑴若假设1成立,则实验现象是________________。
⑵若所得溶液显血红色,则假设_________成立。
⑶为进一步探究,继续向所得溶液加入足量铁粉,若产生_______的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
⑷为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若产生__________现象,则假设2成立;若产生______________现象,则假设3成立。
实验室欲配制0.5 mol·L-1的NaOH溶液500 mL有以下仪器:①烧杯②100 mL量筒③1 000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有(填代号) ,还缺少的仪器是
(2)需称量 g烧碱固体,固体应放在 中称量。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为 。
(4)在配制过程中,其他操作都正确,下列操作会引起误差偏高的是 。
| A.未洗涤烧杯、玻璃棒 |
| B.未等NaOH溶液冷却至室温就转移到容量瓶中 |
| C.容量瓶不干燥,含有少量蒸馏水 |
| D.定容时俯视标线 |
E、摇匀后液面下降,补充水
(5分) 右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中的两处明显的错误是
①;②。
(2)A仪器的名称是____________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,为防止液体暴沸还需加入少量_______。
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
|
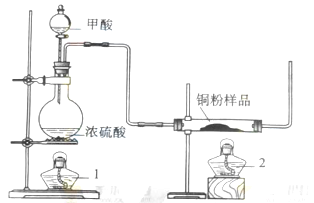 .
.
(16分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)过程I发生反应的离子方程式是。
(2)写出过程III中检查气密性的方法。
⑶过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是,一段时间后使反应停止的操作是,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是,该反应的离子方程式是。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):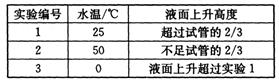
①根据上表得出的结论是温度越(填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO23HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是。
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。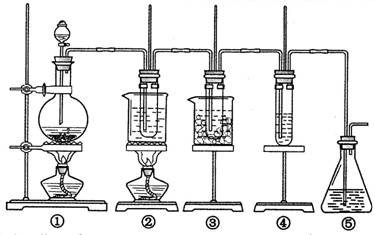
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
A.NaBiO3 B.FeCl3 C.PbO2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①;②。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是(填写编号字母);从②的试管中分离出该晶体的方法是(填写实验操作名称)。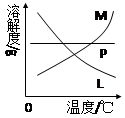
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性。为什么?。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量。